Il solfito di magnesio (MgSO3) è un composto composto da ioni magnesio e solfito. È comunemente usato come conservante alimentare e antiossidante nell’industria alimentare.
| Nome IUPAC | Solfito di magnesio |
| Formula molecolare | MgSO3 |
| numero CAS | 7757-88-2 |
| Sinonimi | Solfonato di magnesio, triossido di zolfo di magnesio, E-536 |
| InChI | InChI=1S/Mg.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Proprietà del solfito di magnesio
Formula di solfito di magnesio
Il solfito di magnesio ha una formula chimica MgSO3, che indica che è composto da un atomo di magnesio, un atomo di zolfo e tre atomi di ossigeno. Lo ione solfito è uno ione poliatomico con la formula SO3 2-, costituito da un atomo di zolfo centrale legato a tre atomi di ossigeno. Lo ione Mg ha una carica pari a +2, mentre lo ione SO3 2- ha una carica pari a -2, rendendo il composto elettricamente neutro.
Massa molare del solfito di magnesio
La massa molare di MgSO3 è 104,37 g/mol, che corrisponde alla somma delle masse atomiche di un atomo di magnesio, un atomo di zolfo e tre atomi di ossigeno. Questo valore è importante per calcolare la quantità di MgSO3 richiesta per una particolare reazione, nonché per determinare la stechiometria delle equazioni chimiche.
Punto di ebollizione del solfito di magnesio
MgSO3 si decompone prima di raggiungere il punto di ebollizione, quindi non ha un punto di ebollizione specifico. Invece, inizia a scomporsi in ossido di magnesio e anidride solforosa a temperature superiori a 700°C. Questo processo di decomposizione può essere accelerato dall’esposizione all’aria o all’umidità, rendendo MgSO3 un composto relativamente instabile.
Solfito di magnesio Punto di fusione
Il punto di fusione di MgSO3 è di circa 150°C. A questa temperatura il composto inizia a decomporsi in ossido di magnesio e anidride solforosa. Il processo di decomposizione è esotermico, ovvero rilascia calore. Il punto di fusione di MgSO3 è importante per comprendere le sue proprietà come solido, come la sua solubilità e la struttura cristallina.
Densità del solfito di magnesio g/mL
La densità di MgSO3 varia a seconda della sua forma fisica, ma generalmente varia da 2,5 a 3,0 g/mL. Questo valore è importante per determinare la massa di un dato volume di MgSO3, nonché per comprenderne il comportamento in soluzione. La densità di MgSO3 può essere utilizzata anche per calcolare la sua densità, che è una misura della sua densità relativa rispetto all’acqua.
Peso molecolare del solfito di magnesio
Il peso molecolare di MgSO3 è 104,37 g/mol. Questo valore è importante per comprendere le proprietà fisiche e chimiche del composto, nonché per calcolare la quantità di MgSO3 richiesta per una particolare reazione. Il peso molecolare di MgSO3 può essere calcolato sommando i pesi atomici di un atomo di magnesio, un atomo di zolfo e tre atomi di ossigeno.
Struttura del solfito di magnesio
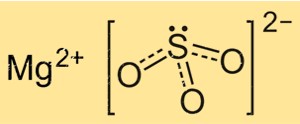
La struttura di MgSO3 si basa su un reticolo cristallino di ioni Mg+2 e ioni SO3 2-. Gli ioni Mg+2 sono circondati da sei atomi di ossigeno disposti in modo ottaedrico, mentre gli ioni SO3 2- sono collegati agli ioni magnesio tramite due atomi di ossigeno. La struttura cristallina di MgSO3 è importante per comprenderne le proprietà fisiche e chimiche, come la solubilità e la reattività.
Solubilità del solfito di magnesio
MgSO3 è scarsamente solubile in acqua, con una solubilità di circa 7,5 g/L a temperatura ambiente. Questa bassa solubilità è dovuta alla struttura cristallina del composto, che rende difficile la penetrazione e la dissoluzione delle molecole d’acqua nel solido. MgSO3 è più solubile in soluzioni acide perché l’acido può reagire con lo ione solfito per formare bisolfito e acido solforoso. La solubilità di MgSO3 è importante per comprendere il suo comportamento in soluzione, nonché per determinarne l’efficacia come conservante alimentare e antiossidante.
| Aspetto | Polvere bianca o cristalli |
| Peso specifico | 2,5 – 3,0 |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 104,37 g/mole |
| Densità | Da 2,5 a 3,0 g/ml |
| Punto di fusione | Intorno ai 150°C |
| Punto di ebollizione | Si decompone sopra i 700°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Leggermente solubile, circa 7,5 g/L a temperatura ambiente |
| Solubilità | Più solubile in soluzioni acide |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli del solfito di magnesio
Il MgSO3 non è considerato una sostanza molto pericolosa. Tuttavia può causare irritazione agli occhi, alla pelle e alle vie respiratorie per contatto o inalazione. L’ingestione di MgSO3 può causare irritazione gastrointestinale ed eventualmente vomito. L’esposizione prolungata ad alte concentrazioni può provocare danni ai polmoni o irritazione delle vie respiratorie. È quindi importante maneggiare MgSO3 con cura, indossando adeguati dispositivi di protezione individuale ed evitando l’inalazione di polveri o fumi. MgSO3 deve essere conservato in un’area fresca, asciutta e ben ventilata, lontano da materiali incompatibili come forti ossidanti, acidi e basi.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Evitare l’inalazione di polvere o fumi. Indossare adeguati dispositivi di protezione individuale. |
| Numeri di identificazione delle Nazioni Unite | Non regolato |
| Codice SA | 2833.29 |
| Classe di pericolo | Non classificato come pericoloso |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità, può causare irritazione agli occhi, alla pelle e alle vie respiratorie per contatto o inalazione. L’ingestione può causare irritazione gastrointestinale ed eventualmente vomito. L’esposizione prolungata ad alte concentrazioni può provocare danni ai polmoni o irritazione delle vie respiratorie. |
Metodi di sintesi del solfito di magnesio
MgSO3 può essere sintetizzato con vari metodi, come la reazione dell’acido solforoso o del biossido di zolfo gassoso con ossido di magnesio o idrossido di magnesio.
In un metodo, la reazione dell’ossido di magnesio con l’acqua forma idrossido di magnesio , che poi reagisce con l’acido solforoso per produrre MgSO3.
Un altro metodo prevede la reazione dell’idrossido di magnesio con il biossido di zolfo gassoso in presenza di acqua per formare MgSO3.
In un altro metodo, la reazione del solfato di magnesio con solfito di sodio o solfito di potassio può sintetizzare MgSO3. Questa reazione produce un precipitato di MgSO3, che i ricercatori possono isolare mediante filtrazione ed essiccazione.
La reazione dell’acetato di magnesio con il biossido di zolfo gassoso in presenza di acqua può preparare MgSO3. Quindi lavare e asciugare il precipitato di MgSO3 risultante.
Questi metodi possono essere utilizzati per produrre MgSO3 per una varietà di applicazioni, tra cui la produzione di carta e pasta di legno, la lavorazione di alimenti e bevande e il trattamento delle acque.
Usi del solfito di magnesio
MgSO3 ha vari usi in diversi settori. Ecco alcuni dei suoi usi comuni:
- Trattamento dell’acqua: utilizzato come assorbitore di ossigeno nel trattamento dell’acqua della caldaia per prevenire la corrosione e la formazione di incrostazioni.
- Lavorazione di alimenti e bevande: utilizzato come conservante e antiossidante nella lavorazione di alimenti e bevande per prolungare la durata di conservazione e prevenirne il deterioramento.
- Produzione di pasta di legno e carta: utilizzato come agente sbiancante nell’industria della pasta di legno e della carta per migliorare la brillantezza e il colore dei prodotti di carta.
- Produzione tessile: utilizzato come agente riducente nella produzione tessile per rimuovere l’ossigeno in eccesso e migliorare la qualità del prodotto finito.
- Agricoltura: utilizzato come spray fogliare per migliorare la crescita delle piante e aumentare la resa dei raccolti.
- Medicina: Utilizzato nella medicina tradizionale per le sue proprietà antiossidanti e antinfiammatorie.
- Cosmetici: utilizzato nei cosmetici come emulsionante, stabilizzante e regolatore del pH.
- Altri usi: utilizzato anche nella produzione di adesivi, vernici e rivestimenti, nonché nei processi di trattamento delle acque reflue.
Domande:
D: Qual è la formula del solfito di magnesio?
R: La formula del solfito di magnesio è MgSO3.
D: Quanto solfito di magnesio è presente in un campione da 2,4 moli?
R: In un campione di 2,4 moli di MgSO3, ci sono 2,4 moli di MgSO3.
D: Qual è la percentuale in massa di ciascun elemento in 1 mole di solfito di magnesio?
R: In una mole di solfito di magnesio, la percentuale in massa di magnesio è del 32,44%, lo zolfo è del 29,44% e l’ossigeno è del 38,12%.
D: Il solfito di magnesio ferma i crampi muscolari?
R: Non ci sono prove scientifiche che suggeriscano che MgSO3 possa fermare i crampi muscolari. Tuttavia, a questo scopo è stato utilizzato il solfato di magnesio (sale di Epsom).
D: Qual è l’effetto dell’aggiunta di solfito di magnesio alle reazioni?
R: L’aggiunta di MgSO3 può agire come agente riducente in alcune reazioni rimuovendo l’ossigeno. Può anche agire come conservante e antiossidante in alcune applicazioni.
D: Il solfito di magnesio è ionico o molecolare?
R: MgSO3 è un composto ionico.
