Il solfato di potassio (K2SO4) è un composto che contiene potassio, zolfo e ossigeno. È comunemente usato come fertilizzante per fornire nutrienti essenziali alle piante e migliorare la qualità del suolo.
| Nome IUPAC | Solfato di potassio |
| Formula molecolare | K2SO4 |
| numero CAS | 7778-80-5 |
| Sinonimi | Acido solforico, sale dipotassico; Solfato dipotassico; Arcanite; Acido solforico, sale di potassio (1:2); solfato di potassio; sal policresto; duplicato arcano |
| InChI | InChI=1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Proprietà del solfato di potassio
Formula di solfato di potassio
La formula chimica del solfato di potassio è K2SO4. Ciò significa che ciascuna molecola di solfato di potassio contiene due atomi di potassio, un atomo di zolfo e quattro atomi di ossigeno. La formula del solfato di potassio è utile per determinare la stechiometria delle reazioni che coinvolgono il composto, nonché per calcolare la quantità di solfato di potassio necessaria per un’applicazione specifica.
Massa molare del solfato di potassio
K2SO4 ha una massa molare di circa 174.259 g/mol. Questo valore viene calcolato sommando le masse atomiche di ciascun elemento nel composto, che sono due atomi di potassio, un atomo di zolfo e quattro atomi di ossigeno. La massa molare è un valore utile per determinare la quantità di K2SO4 necessaria per un’applicazione specifica, come la produzione di fertilizzanti o esperimenti di laboratorio.
Punto di ebollizione del solfato di potassio
Il punto di ebollizione di K2SO4 è di circa 1.690 °C (3.074 °F). Questa è la temperatura alla quale il composto passa da liquido a gassoso. L’alto punto di ebollizione di K2SO4 lo rende utile per applicazioni che richiedono stabilità alle alte temperature, come nella produzione di fertilizzanti e prodotti chimici industriali.
Punto di fusione del solfato di potassio
Il punto di fusione di K2SO4 è di circa 1,069 °C (1,956 °F). Questa è la temperatura alla quale il composto solido passa allo stato liquido. Il punto di fusione relativamente alto di K2SO4 lo rende utile per applicazioni ad alta temperatura, come nella produzione di vetro, ceramica e fertilizzanti.
Densità del solfato di potassio g/mL
La densità di K2SO4 è di circa 2,66 g/mL a temperatura ambiente. Ciò significa che un millilitro di K2SO4 pesa 2,66 grammi. La densità di K2SO4 dipende dalla temperatura e dalla pressione e può essere utilizzata per calcolare la massa o il volume del composto necessario per un’applicazione specifica.
Peso molecolare del solfato di potassio
Il peso molecolare di K2SO4 è 174.259 g/mol. Questo valore si calcola sommando i pesi atomici di tutti gli elementi presenti nel composto. Il peso molecolare è utile per calcolare la quantità di K2SO4 necessaria per applicazioni specifiche, come fertilizzanti o prodotti chimici industriali.
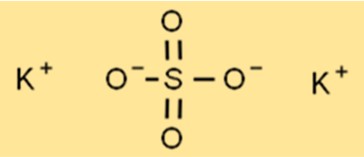
Struttura del solfato di potassio
La struttura di K2SO4 è una struttura reticolare cristallina, con ciascuno ione potassio circondato da sei ioni ossigeno a forma ottaedrica. L’atomo di zolfo si trova al centro del reticolo, con ciascun atomo di zolfo circondato da quattro ioni di ossigeno in una forma tetraedrica. Questa struttura reticolare conferisce al K2SO4 le sue proprietà caratteristiche, come i suoi elevati punti di fusione e di ebollizione.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2,66 a 20°C |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 174,259 g/mole |
| Densità | 2,66 g/cm³ a 20°C |
| Punto di fusione | 1069°C (1956°F) |
| Punto di ebollizione | 1.690°C (3.074°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | 111 g/l a 20°C |
| Solubilità | Solubile in acqua, insolubile in etanolo |
| Pressione del vapore | 0,0 mmHg a 25°C |
| Densità del vapore | Non applicabile |
| pKa | 1°: 2,17; 2°: 7:20; 3°: 11.8 |
| pH | 5,5-8,5 (soluzione all’1%) |
Sicurezza e pericoli del solfato di potassio
K2SO4 è generalmente considerato sicuro per l’uso in ambienti industriali, agricoli e di laboratorio. Tuttavia, il composto può causare irritazione o danni alla pelle, agli occhi e al sistema respiratorio se ingerito o inalato in grandi quantità. Inoltre, K2SO4 può reagire con alcune sostanze chimiche, come gli acidi forti, per produrre fumi o incendi pericolosi. È importante maneggiare K2SO4 con cura, utilizzando dispositivi di protezione adeguati e seguendo le istruzioni di sicurezza. Lo stoccaggio di K2SO4 deve avvenire in un’area fresca, asciutta e ben ventilata, lontano da materiali incompatibili.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | S24/25: Evitare il contatto con la pelle e gli occhi. |
| Numeri di identificazione delle Nazioni Unite | ONU 6066 |
| Codice SA | 3104.30.00 |
| Classe di pericolo | Non pericoloso per il trasporto |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità |
Metodi di sintesi del solfato di potassio
Esistono diversi metodi per sintetizzare K2SO4.
Un metodo comune prevede la reazione del cloruro di potassio con acido solforico . La reazione produce K2SO4 e acido cloridrico come sottoprodotto.
Un altro metodo prevede la reazione dell’idrossido di potassio con acido solforico . Questa reazione produce anche K2SO4 e acqua come sottoprodotto.
K2SO4 può anche essere ottenuto dal minerale langbeinite, che è un minerale naturale contenente K2SO4, solfato di magnesio e cloruro di sodio. In genere, i minatori estraggono il minerale e lo lavorano per rimuovere le impurità e separare il K2SO4.
Un altro metodo per produrre K2SO4 prevede la reazione del carbonato di potassio con acido solforico . Questa reazione produce K2SO4 e anidride carbonica come sottoprodotto.
Usi del solfato di potassio
K2SO4 ha una vasta gamma di applicazioni in vari settori. Ecco alcuni degli usi più comuni di K2SO4:
- Fertilizzante: un fertilizzante popolare grazie al suo alto contenuto di potassio. Utilizzato nella coltivazione di frutta, verdura e altre colture.
- Industria del vetro: utilizzato come fondente nella produzione del vetro. Ciò aiuta ad abbassare il punto di fusione del vetro e a migliorarne la durata.
- Industria farmaceutica: utilizzato come componente in vari farmaci, inclusi lassativi e soluzioni di sostituzione degli elettroliti.
- Industria alimentare: utilizzato come additivo alimentare per regolare l’acidità e come agente lievitante nei prodotti da forno.
- Applicazioni industriali: utilizzato in diverse applicazioni industriali, inclusa la produzione di alluminio, carbonato di potassio e altri prodotti chimici.
- Mangime per animali: utilizzato come integratore alimentare per bestiame e pollame per promuovere una crescita e uno sviluppo sani.
- Trattamento dell’acqua: utilizzato nel trattamento dell’acqua per controllare le incrostazioni e la corrosione nelle caldaie e in altre apparecchiature.
Domande:
D: Il solfato di potassio è solubile?
R: Sì, K2SO4 è solubile in acqua. Ha una solubilità di circa 111 g/L a temperatura ambiente.
D: Quale sarà il prodotto solido quando il bromuro di stronzio e il solfato di potassio reagiscono?
R: Quando il bromuro di stronzio e K2SO4 reagiscono, il prodotto solido formato è solfato di stronzio (SrSO4) che è un solido bianco insolubile.
D: Cos’altro viene prodotto nella reazione di sostituzione del nitrato d’argento e del solfato di potassio?
R: Nella reazione di sostituzione del nitrato d’argento e K2SO4, vengono prodotti anche solfato d’argento (Ag2SO4) e nitrato di potassio (KNO3).
D: Il solfato di potassio è un acido o una base?
R: K2SO4 non è né un acido né una base, è un sale. Si forma dalla reazione di neutralizzazione tra un acido (acido solforico) e una base (idrossido di potassio).
D: Il k2so4 è solubile in acqua?
R: Sì, K2SO4 è solubile in acqua. È molto solubile e la sua solubilità aumenta con la temperatura.
D: Quale sale viene prodotto quando l’h2so4 reagisce con il naoh? k2so3 na2so4 na2so3 k2so4 A: Quando H2SO4 reagisce con NaOH, il sale prodotto è Na2SO4 (solfato di sodio) con acqua.
D: Quante moli di k2so4 ci sono in 15,0 g di k2so4?
R: Per determinare il numero di moli di K2SO4 in 15,0 g di K2SO4, dobbiamo dividere la massa data per la massa molare di K2SO4 che è 174,259 g/mol. Quindi il numero di moli di K2SO4 in 15,0 g è 0,086 moli.
D: Quale sarebbe la formula del precipitato che si forma quando si mescolano pb(no3)2 (aq) e k2so4 (aq)?
R: Quando si miscelano Pb(NO3)2 (aq) e K2SO4 (aq), il precipitato formato è PbSO4 (solfato di piombo), che è un solido bianco insolubile. L’equazione bilanciata per questa reazione è Pb(NO3)2 + K2SO4 → PbSO4 + 2KNO3.
