Il solfato di magnesio (solfato) o MgSo4 è un composto chimico composto da magnesio, zolfo e ossigeno. È comunemente usato in medicina come lassativo, anticonvulsivante e per trattare la carenza di magnesio.
| Nome IUPAC | Solfato di magnesio |
| Formula molecolare | MgSO4 |
| numero CAS | 7487-88-9 |
| Sinonimi | sale Epsom; sale inglese; Sale amaro; Sale da bagno; sale Epsom; Sal anglicum; Solfato di magnesio eptaidrato |
| InChI | InChI=1S/Mg.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Formula di solfato di magnesio
La formula chimica del solfato di magnesio è MgSO4. Questa formula indica che il solfato di magnesio è composto da un catione di magnesio (Mg2+) e un anione solfato (SO42-). La formula del solfato di magnesio è importante nei calcoli chimici perché aiuta a determinare la quantità di una sostanza necessaria in una reazione chimica.
Massa molare di MgSO4
La massa molare del solfato di magnesio è 120,366 g/mol. Questo valore si calcola sommando le masse atomiche di un atomo di magnesio (24.305 g/mol), un atomo di zolfo (32.066 g/mol) e quattro atomi di ossigeno (15.999 g/mol ciascuno). La massa molare è un parametro importante nei calcoli chimici perché aiuta a determinare la quantità di una sostanza necessaria in una reazione chimica.
Punto di ebollizione del solfato di magnesio
Il punto di ebollizione del solfato di magnesio dipende dallo stato del composto. Il solfato di magnesio esiste in due forme, anidro ed eptaidrato. La forma anidra ha un punto di ebollizione più alto di 1.124 °C (2.055 °F), mentre la forma eptaidrata ha un punto di ebollizione più basso di 150 °C (302 °F). Il punto di ebollizione del solfato di magnesio può essere influenzato da fattori quali pressione e impurità.
Punto di fusione del solfato di magnesio
Il punto di fusione del solfato di magnesio dipende anche dallo stato del composto. La forma anidra ha un punto di fusione più alto di 1.124 °C (2.055 °F), mentre la forma eptaidrata ha un punto di fusione più basso di 150 °C (302 °F). Il punto di fusione del solfato di magnesio può anche essere influenzato da fattori quali pressione e impurità.
Densità del solfato di magnesio g/ml
La densità del solfato di magnesio varia a seconda dello stato del composto. La forma anidra ha una densità di 2,66 g/cm³, mentre la forma eptaidrata ha una densità di 1,68 g/cm³. La densità è una proprietà fisica di una sostanza che indica la quantità di massa per unità di volume. La densità del solfato di magnesio può essere utilizzata per calcolare il volume di una sostanza necessaria per una reazione chimica.
Peso molecolare del solfato di magnesio
Il peso molecolare del solfato di magnesio è 120.366 g/mol. Questo valore si calcola sommando le masse atomiche di un atomo di magnesio (24.305 g/mol), un atomo di zolfo (32.066 g/mol) e quattro atomi di ossigeno (15.999 g/mol ciascuno). Il peso molecolare è un parametro importante nei calcoli chimici perché aiuta a determinare la quantità di una sostanza necessaria in una reazione chimica.
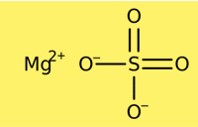
Struttura del solfato di magnesio
Il solfato di magnesio ha una struttura cristallina. La forma anidra ha una struttura cristallina romboedrica, mentre la forma eptaidrata ha una struttura cristallina monoclina. La struttura cristallina del solfato di magnesio è composta da cationi magnesio e anioni solfato. La forma anidra contiene un catione di magnesio e un anione solfato per cellula, mentre la forma eptaidrata contiene un catione di magnesio e due anioni solfato per cellula.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2,66 (anidro) 1,68 (eptaidrato) |
| Colore | Da incolore a bianco |
| Odore | Inodore |
| Massa molare | 120.366 g/mole |
| Densità | 2,66 g/cm³ (anidro) 1,68 g/cm³ (eptaidrato) |
| Punto di fusione | 1124°C (anidro) 150°C (eptaidrato) |
| Punto di ebollizione | 1124°C (anidro) 150°C (eptaidrato) |
| Punto flash | Non applicabile |
| solubilità in acqua | 71,6 g/100 ml (20°C) |
| Solubilità | Solubile in acqua ed etanolo |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| PKa | 9,99 |
| pH | 6,0 – 8,0 (soluzione al 5%) |
Sicurezza e pericoli del solfato di magnesio
Il solfato di magnesio è generalmente considerato sicuro se maneggiato correttamente. Tuttavia, può comportare alcuni pericoli se non maneggiato con attenzione. L’esposizione alla polvere di solfato di magnesio può irritare gli occhi, la pelle e il sistema respiratorio. L’ingestione o l’iniezione di grandi quantità di solfato di magnesio può causare diarrea, crampi allo stomaco e disidratazione. È importante indossare dispositivi di protezione, come guanti e occhiali protettivi, quando si maneggia il solfato di magnesio per evitare irritazioni alla pelle e agli occhi. In caso di ingestione o esposizione, consultare immediatamente un medico. Il solfato di magnesio deve essere conservato in un luogo fresco e asciutto, lontano da fonti di calore e materiali incompatibili.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | S22 – Non respirare le polveri; S24/25 – Evitare il contatto con la pelle e gli occhi; S36 – Indossare indumenti protettivi idonei; S26 – In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico; S45 – In caso di incidente o di malessere consultare immediatamente il medico (se possibile mostrare al medico l’etichetta) |
| Identificatori AN | UN3077 |
| Codice SA | 28332100 |
| Classe di pericolo | 9 |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto) > 3.000 mg/kg; LD50 (cutaneo, ratto) > 2.000 mg/kg |
Metodi di sintesi del solfato di magnesio
Esistono diversi metodi per sintetizzare il solfato di magnesio (MgSO4).
Un metodo comune consiste nel far reagire l’ossido di magnesio o l’idrossido di magnesio con acido solforico. Il processo prevede l’aggiunta di ossido o idrossido di magnesio all’acido solforico mescolando finché la miscela non si dissolve completamente. Raccogliere i cristalli di magnesio MgSO4 facendo evaporare la soluzione per rimuovere l’acqua in eccesso.
Un altro approccio consiste nell’aggiungere lentamente carbonato di magnesio all’acido solforico mescolando fino a completa dissoluzione. Per ottenere cristalli di magnesio MgSO4, filtrare la soluzione risultante per eliminare tutte le impurità ed evaporarla.
Reagire il magnesio con acido solforico e riscaldare la miscela fino al completamento della reazione, quindi filtrare ed evaporare la soluzione risultante per ottenere i cristalli di magnesio MgSO4.
È anche possibile ottenere magnesio MgSO4 facendo reagire il cloruro di magnesio con sodio MgSO4. Il processo prevede l’aggiunta di cloruro di magnesio a una soluzione di sodio MgSO4, l’agitazione della miscela risultante e il riscaldamento fino alla formazione di cristalli di magnesio MgSO4.
Usi del solfato di magnesio
Il solfato di magnesio (MgSO4) ha molte applicazioni in vari campi. Alcuni dei suoi usi includono:
- Usi medici: utilizzato come trattamento per l’eclampsia e la preeclampsia durante la gravidanza, nonché per prevenire convulsioni in pazienti con asma grave o ipomagnesiemia. Ha funzione catartica e lassativa.
- Agricoltura: utilizzato come fertilizzante grazie al suo alto contenuto di magnesio e zolfo. Gli agricoltori lo usano per correggere le carenze di magnesio nei terreni.
- Industria alimentare e delle bevande: utilizzato come sale da distillazione nella produzione della birra per regolare la chimica dell’acqua e migliorarne il sapore. L’industria alimentare lo utilizza come coagulante nella produzione del tofu.
- Applicazioni industriali: utilizzato come agente essiccante ed essiccante, nonché come ritardante di fiamma. Varie industrie lo utilizzano nella produzione di tessuti, carta e prodotti chimici.
- Cura personale: le persone usano il solfato di magnesio nei sali da bagno e nei pediluvi per i suoi benefici per la salute dichiarati, tra cui la riduzione del dolore muscolare e della rigidità.
- Altri usi: Utilizzato nella produzione di pigmenti, esplosivi e nella purificazione dei metalli.
Domande:
D: Qual è la base utilizzata nel dentifricio?
R: La base più comunemente utilizzata nel dentifricio è solitamente il carbonato di calcio o il bicarbonato di sodio. Queste basi aiutano a strofinare i denti e rimuovere la placca.
D: A cosa serve il solfato di magnesio?
R: Il solfato di magnesio ha una varietà di usi, tra cui come trattamento per l’eclampsia e la preeclampsia durante la gravidanza, come catartico e lassativo, come fertilizzante, come sale per birra, come ritardante di fiamma e come agente essiccante. Viene utilizzato anche nella produzione di tessuti, carta e prodotti chimici.
D: Il solfato di magnesio è solubile?
R: Il solfato di magnesio è solubile in acqua e alcool.
D: Il solfato di magnesio è solubile in acqua?
R: Sì, il solfato di magnesio è altamente solubile in acqua, con una solubilità di circa 25,5 g/100 ml a temperatura ambiente.
D: A cosa serve il solfato di magnesio?
R: Il solfato di magnesio ha vari usi e vantaggi a seconda dell’applicazione specifica. Alcuni dei suoi usi includono come trattamento medico, come fertilizzante, come sale per birra, come ritardante di fiamma e come agente essiccante. In medicina, il solfato di magnesio può essere utilizzato per prevenire convulsioni, trattare la stitichezza e ridurre il dolore e la rigidità muscolare.
