Il solfato di alluminio è un sale inorganico comunemente utilizzato come agente coagulante nei processi di trattamento dell’acqua e come agente flocculante nella purificazione dei liquidi.
| Nome IUPAC | Solfato di alluminio |
| Formula molecolare | Al2(SO4)3 |
| numero CAS | 10043-01-3 |
| Sinonimi | Solfato di alluminio, solfato di alluminio, allume di torta, allume di cartiera, allume di filtro |
| InChI | InChI=1S/2Al.3H2O.14H2SO4/c;;31-5(2,3)4/h;;(H2,1,2,3,4)/q2+3;/p-3 |
Formula di solfato di alluminio
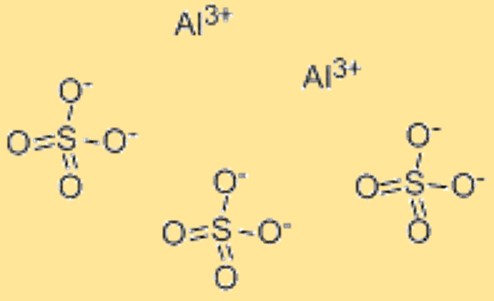
La formula chimica del solfato di alluminio è Al2(SO4)3. Questa formula rappresenta il rapporto degli atomi nel solfato di alluminio e viene utilizzata per indicare la composizione del composto. La formula può essere utilizzata anche nei calcoli chimici, come determinare la massa molare o il numero di moli di solfato di alluminio in un dato campione. La formula chimica del solfato di alluminio fornisce un modo conveniente per rappresentare la composizione del materiale ed è ampiamente riconosciuta nella comunità scientifica. Inoltre, la formula può essere utilizzata per prevedere le proprietà chimiche e fisiche del solfato di alluminio, come la sua solubilità in acqua, la sua reattività con altri composti e la sua stabilità in diverse condizioni.
Massa molare del solfato di alluminio
La massa molare del solfato di alluminio è 342,15 g/mol. Questo valore è importante in vari calcoli chimici e fisici, inclusa la determinazione delle concentrazioni molari, la stechiometria delle reazioni e la legge dei gas ideali. La massa molare viene calcolata sommando i pesi atomici di tutti gli atomi nella formula chimica del solfato di alluminio, che è Al2(SO4)3. La massa molare può anche essere utilizzata per convertire la massa in numero di moli per un dato campione di solfato di alluminio.
Punto di ebollizione del solfato di alluminio
Il punto di ebollizione del solfato di alluminio non è ben definito perché si decompone prima dell’ebollizione. Il solfato di alluminio è un sale idrato e quando riscaldato perde l’acqua di idratazione e si decompone in ossido di alluminio e acido solforico. La temperatura di decomposizione può variare da 120°C a 140°C, a seconda del grado di idratazione. Anche la presenza di impurità nel campione può influenzare la temperatura di decomposizione.
Punto di fusione del solfato di alluminio
Il punto di fusione del solfato di alluminio è di circa 1200°C. Questa elevata temperatura è dovuta ai forti legami ionici tra alluminio e ioni zolfo. Il solfato di alluminio è un solido cristallino a temperatura ambiente e ha una struttura cristallina ben definita, che contribuisce al suo elevato punto di fusione. Il punto di fusione del solfato di alluminio è importante per determinare le condizioni di lavorazione richieste per la sintesi e la purificazione del materiale.
Densità del solfato di alluminio g/ml
La densità del solfato di alluminio è compresa tra 1,8 e 2,0 g/ml. Questo valore può variare a seconda del grado di idratazione e della presenza di impurità nel campione. La densità del solfato di alluminio è un’importante proprietà fisica che può essere utilizzata per calcolare il volume di una determinata massa del materiale. La densità del solfato di alluminio è utile anche per determinare la concentrazione di una soluzione, perché consente di calcolare la massa di soluto per unità di volume di solvente.
Peso molecolare del solfato di alluminio
Determiniamo che il peso molecolare del solfato di alluminio è 342,15 g/mol aggiungendo i pesi atomici di tutti gli atomi nella sua formula chimica Al2(SO4)3. Questo valore serve sia come peso molecolare che come massa molare e svolge un ruolo cruciale nei calcoli chimici, inclusa la determinazione delle concentrazioni molari e la stechiometria della reazione.
Struttura in solfato di alluminio
Il solfato di alluminio ha una struttura cristallina composta da cationi di alluminio (Al3+) e anioni solfato (SO4^2-). I cationi alluminio si coordinano con sei anioni solfato in una stretta disposizione esagonale, tenuti insieme da forti legami ionici. La struttura cristallina del solfato di alluminio influenza le sue proprietà fisiche, come il punto di fusione e la solubilità.
| Aspetto | Solido cristallino |
| Peso specifico | da 1,8 a 2,0 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 342,15 g/mole |
| Densità | da 1,8 a 2,0 g/ml |
| Punto di fusione | 770°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile in acqua |
| Solubilità | Solubile in acqua |
| Pressione del vapore | Non ben definito |
| Densità del vapore | Non ben definito |
| pKa | Non ben definito |
| pH | Neutro |
Sicurezza e pericoli del solfato di alluminio
Il solfato di alluminio è una sostanza pericolosa che deve essere maneggiata con cura. L’inalazione delle sue polveri può causare irritazione delle vie respiratorie e tosse. Il contatto con la pelle o gli occhi può provocare arrossamento, prurito e sensazione di bruciore. L’ingestione di solfato di alluminio può causare irritazione gastrointestinale, inclusi nausea, vomito e diarrea. Se ingerito in grandi quantità, può portare a problemi di salute più gravi, come depressione del sistema nervoso centrale e danni ai reni. Pertanto, è importante indossare dispositivi di protezione individuale, come guanti e occhiali protettivi, quando si maneggia il solfato di alluminio. Inoltre, l’area di lavoro deve essere ben ventilata per ridurre il rischio di inalazione di polvere. In caso di contatto con la pelle o gli occhi, sciacquare la zona interessata con abbondante acqua per almeno 15 minuti e consultare immediatamente un medico.
| Simboli di pericolo | Xi – Irritante |
| Descrizione della sicurezza | S24/25 – Evitare il contatto con la pelle e gli occhi |
| Identificatori AN | UN3077 – Rischio ambientale |
| Codice SA | 2833.30.00 |
| Classe di pericolo | 8 – Sostanza corrosiva |
| Gruppo di imballaggio | III |
| Tossicità | Tossicità da bassa a moderata se ingerito, inalato o a contatto con la pelle o gli occhi |
Metodi di sintesi del solfato di alluminio
Il solfato di alluminio può essere sintetizzato con vari metodi, inclusa la precipitazione e la reazione con acido solforico.
Un metodo di sintesi è il metodo della precipitazione, che prevede la miscelazione di una soluzione di sali di alluminio con acido solforico. Questa reazione porta alla formazione di solfato di alluminio, che precipita dalla soluzione in forma solida. Il solido può quindi essere filtrato, lavato ed essiccato per ottenere solfato di alluminio puro.
Un altro metodo di sintesi è il metodo di reazione, che prevede la miscelazione di idrossido di alluminio o ossido di alluminio con acido solforico. Questa reazione porta alla formazione di solfato di alluminio e acqua. Il prodotto può poi essere purificato mediante lavaggio ed asciugatura.
In entrambi i metodi, la purezza del prodotto finale può essere migliorata utilizzando materiali di partenza ad elevata purezza e controllando attentamente le condizioni di reazione. La purezza del solfato di alluminio può essere verificata analizzando le sue proprietà fisiche e chimiche, come la massa molare, il punto di fusione e la solubilità in acqua.
Nel complesso, la sintesi del solfato di alluminio è un processo relativamente semplice che può essere eseguito in laboratorio o in ambiente industriale, a seconda della scala di produzione desiderata. La scelta del metodo di sintesi dipenderà dalla disponibilità delle materie prime, dalla purezza desiderata del prodotto e dalla scala di produzione desiderata.
Usi del solfato di alluminio
Le industrie utilizzano il solfato di alluminio per la sua versatilità in varie applicazioni come il trattamento delle acque, la produzione di carta e l’agricoltura. Nel trattamento dell’acqua, la sostanza agisce come coagulante e purifica l’acqua potabile facendo sì che le impurità si aggreghino e formino particelle più grandi che possono essere facilmente filtrate. L’industria della produzione della carta utilizza il solfato di alluminio come riempitivo e legante per migliorare la resistenza e la lucentezza della carta e regolare i livelli di pH nella pasta. In agricoltura, il solfato di alluminio abbassa il pH del terreno e aumenta l’acidità, fornendo alle piante nutrienti essenziali come zolfo e alluminio. Il solfato di alluminio ha anche altri usi, tra cui la concia della pelle, i tessuti ignifughi e come flocculante nel trattamento delle acque reflue. Pertanto, il solfato di alluminio svolge un ruolo importante nella vita moderna servendo a diversi scopi in vari settori.
Domande:
Qual è la formula del solfato di alluminio?
La formula chimica del solfato di alluminio è Al2(SO4)3.
Il solfato di alluminio è solubile?
Sì, il solfato di alluminio è solubile in acqua. Si dissolve in acqua per formare una soluzione di ioni alluminio, solfato e idrossido. La solubilità del solfato di alluminio in acqua dipende dalla temperatura, il che significa che è più solubile a temperature più elevate e meno solubile a temperature più basse. A temperatura ambiente, il solfato di alluminio è facilmente solubile in acqua, con una solubilità di circa 20 grammi per 100 ml di acqua.
