Il solfato d’argento (Ag2SO4) è un solido bianco utilizzato in fotografia e chimica analitica. Si dissolve in acqua e, una volta riscaldato, si decompone in ossido d’argento e triossido di zolfo.
| Nome IUPAC | Solfato d’argento |
| Formula molecolare | Ag2SO4 |
| numero CAS | 10294-26-5 |
| Sinonimi | Solfato d’argento, solfato di diargento, acido solforico d’argento, monosolfato di diargento |
| InChI | InChI=1S/2Ag.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Proprietà del solfato d’argento
Formula di solfato d’argento
La formula chimica del solfato diargent è Ag2SO4. È costituito da due atomi di argento (Ag) legati a un atomo di zolfo (S) e quattro atomi di ossigeno (O). La formula rappresenta il rapporto tra gli atomi in una molecola di diargent solfato.
Massa molare del solfato d’argento
La massa molare del solfato di diargento viene calcolata sommando le masse atomiche dei suoi elementi costitutivi. L’argento ha una massa atomica di 107,87 grammi per mole (g/mol), lo zolfo ha una massa atomica di 32,07 g/mol e l’ossigeno ha una massa atomica di 16,00 g/mol. Sommandoli insieme, la massa molare del diargent solfato è di circa 311,81 g/mol.
Punto di ebollizione del solfato d’argento
Il solfato di diargent non ha un punto di ebollizione distinto perché si decompone prima di raggiungere il punto di ebollizione. Quando riscaldato, subisce una decomposizione termica e si scompone in ossido d’argento (Ag2O) e triossido di zolfo (SO3). Pertanto, il punto di ebollizione del diargent solfato non è applicabile.
Solfato d’argento Punto di fusione
Il punto di fusione del solfato di diargent è di circa 652 gradi Celsius (1.206 gradi Fahrenheit). A questa temperatura, il solfato diargent passa dallo stato solido allo stato liquido fuso. È importante notare che il punto di fusione può variare leggermente a seconda della purezza del campione di solfato diargent.
Densità del solfato d’argento g/mL
La densità del diargent solfato è di circa 5,45 grammi per millilitro (g/mL). Questo valore indica la massa di solfato diargent per unità di volume. La densità di una sostanza dipende generalmente dalla temperatura, quindi è importante considerare le condizioni quando si misura la densità del solfato di diargent.
Peso molecolare del solfato d’argento
Il peso molecolare del diargent solfato viene calcolato sommando i pesi atomici dei suoi elementi costitutivi, tenendo conto della stechiometria della formula. Nel caso del solfato di diargento (Ag2SO4), il peso molecolare è di circa 311,81 grammi per mole (g/mol).
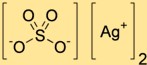
Struttura del solfato d’argento
Il solfato di diargento ha una struttura cristallina composta da cationi argento (Ag+) e anioni solfato (SO4^2-). I cationi argento sono circondati da atomi di ossigeno provenienti da anioni solfato, formando una rete tridimensionale.
Solubilità del solfato d’argento
Il solfato di diargent è scarsamente solubile in acqua. Si dissolve in misura limitata, circa 0,8 grammi si sciolgono in 100 ml di acqua a temperatura ambiente. La solubilità può essere influenzata da fattori quali la temperatura e la presenza di altri soluti nella soluzione.
| Aspetto | Solido bianco |
| Peso specifico | N / A |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 311,81 g/mole |
| Densità | 5,45 g/ml |
| Punto di fusione | 652°C (1206°F) |
| Punto di ebollizione | Decomposto |
| Punto flash | N / A |
| solubilità in acqua | Scarsamente solubile |
| Solubilità | Si scioglie in acqua. acidi, alcoli, acetone, etere, acetati, ammidi |
| Pressione del vapore | N / A |
| Densità del vapore | N / A |
| pKa | N / A |
| pH | N / A |
Sicurezza e pericoli del solfato d’argento
Il solfato di diargent presenta alcuni rischi per la sicurezza e occorre prestare attenzione quando lo si maneggia. È importante evitare l’inalazione, l’ingestione o il contatto con la pelle e gli occhi. Quando si maneggia il diargent solfato, è consigliabile indossare adeguati dispositivi di protezione individuale, inclusi guanti, occhiali e camice da laboratorio. In caso di esposizione accidentale, sciacquare abbondantemente le aree interessate con acqua. Il diargent solfato può causare irritazione alla pelle e agli occhi e un’esposizione prolungata o ripetuta può portare a sensibilizzazione. È inoltre necessario maneggiare il diargent solfato in un’area ben ventilata per ridurre al minimo il rischio di inalazione. Per garantire la sicurezza è necessario seguire le corrette procedure di conservazione, etichettatura e smaltimento.
| Simboli di pericolo | Nessun simbolo |
| Descrizione della sicurezza | Evitare l’inalazione, l’ingestione e il contatto con la pelle e gli occhi. Indossare DPI. Maneggiare in un’area ben ventilata. Conservazione, etichettatura e smaltimento adeguati. |
| Numeri di identificazione delle Nazioni Unite | N / A |
| Codice SA | 28429090 |
| Classe di pericolo | N / A |
| Gruppo di imballaggio | N / A |
| Tossicità | Irritante per la pelle e gli occhi. L’esposizione prolungata/ripetuta può causare sensibilizzazione. |
Metodi per la sintesi del solfato d’argento
Esistono diversi metodi per sintetizzare il diargent solfato.
Un metodo comune prevede la reazione tra nitrato d’argento (AgNO3) e acido solforico (H2SO4) . In laboratorio, mentre si agita, gli scienziati aggiungono lentamente nitrato d’argento a una soluzione di acido solforico, determinando la formazione di un precipitato bianco chiamato solfato diargent. Raccolgono il precipitato, lo lavano e lo asciugano per ottenere solfato diargent puro.
Gli scienziati ottengono il solfato d’argento anche aggiungendo ossido d’argento (Ag2O) all’acido solforico e riscaldando la miscela mescolando. Questo processo produce solfato diargentante come precipitato, che viene filtrato, lavato ed essiccato per ottenere il prodotto finale.
Inoltre, gli scienziati possono ottenere solfato d’argento riscaldando una miscela di cloruro d’argento (AgCl) e acido solforico concentrato. Aggiungono cloruro d’argento all’acido solforico e applicano calore alla miscela. La reazione porta alla formazione di solfato d’argento come precipitato, che può essere raccolto, lavato ed essiccato.
È importante notare che questi metodi di sintesi devono essere eseguiti con adeguate precauzioni di sicurezza, compreso l’uso di dispositivi di protezione adeguati e il lavoro in un’area ben ventilata.
Usi del solfato d’argento
Il solfato di diargento ha diversi usi in diversi campi grazie alle sue proprietà uniche. Ecco alcune delle sue applicazioni comuni:
- Fotografia: nella fotografia in bianco e nero, i fotografi utilizzano il solfato di diargent come componente delle emulsioni fotosensibili per catturare e sviluppare immagini reagendo con la luce.
- Chimica analitica: vari metodi analitici utilizzano il solfato d’argento come reagente per rilevare e quantificare gli alogenuri, come gli ioni cloruro e bromuro, attraverso reazioni di precipitazione.
- Galvanotecnica: i processi di galvanoplastica utilizzano solfato diargent per depositare uno strato di argento su superfici conduttive, creando rivestimenti decorativi o protettivi su gioielli, dispositivi elettronici e altri oggetti.
- Agente antimicrobico: grazie alle sue proprietà antimicrobiche, il diargent solfato trova applicazione nella formulazione di medicazioni, unguenti e dispositivi medici. Aiuta a prevenire le infezioni e favorisce la guarigione.
- Industria delle batterie: l’industria delle batterie lo utilizza come componente cruciale nel materiale degli elettrodi per la produzione di batterie argento-zinco e argento-cadmio, che sono prevalenti nei dispositivi elettronici e nelle apparecchiature mediche.
- Reagente di laboratorio: il solfato di diargento viene utilizzato come reagente in una varietà di esperimenti di laboratorio, inclusa la sintesi di altri composti d’argento e nelle reazioni di chimica organica.
- Produzione del vetro: nella produzione del vetro, svolge un ruolo fondamentale nella produzione di vetri speciali, compresi specchi argentati e rivestimenti conduttivi per finestre. I produttori applicano uno strato sottile di solfato diargent per ottenere queste proprietà desiderate.
- Catalizzatore: il solfato di diargento agisce come catalizzatore in alcune reazioni chimiche, comprese le reazioni di ossidazione e i processi di polimerizzazione.
Domande:
D: Cos’altro viene prodotto nella reazione di sostituzione del nitrato d’argento e del solfato di potassio?
R: Nella reazione di sostituzione di AgNO3 e K2SO4, i prodotti formati sono nitrato di potassio (KNO3) e solfato diargentico (Ag2SO4).
D: Se alla soluzione viene aggiunto ulteriore solfato d’argento solido, si dissolverà?
R: Sì, il solfato di diargento solido aggiuntivo si dissolverà nella soluzione poiché è scarsamente solubile in acqua.
D: Si verificano precipitazioni quando nitrato d’argento + solfato di sodio?
R: Sì, la precipitazione avviene quando AgNO3 reagisce con il solfato di sodio, dando luogo alla formazione di un precipitato solido Ag2SO4.
D: Qual è la percentuale di argento nel solfato d’argento?
R: La percentuale di Ag nel solfato diargent è di circa il 63,48%.
D: Il solfato d’argento è solubile o insolubile?
R: Il solfato di Diargent è scarsamente solubile in acqua.
D: Come trovare la formula chimica del solfato d’argento?
R: La formula chimica del solfato di diargento è Ag2SO4, che può essere determinata in base alla valenza del catione Ag+ e dell’anione SO4-2.
D: Qual è il colore di Ag2SO4?
R: Il solfato di diargento (Ag2SO4) è un solido bianco.
D: Qual è il valore Ksp per Ag2SO4 se 5,49 g sono solubili in 1,00 L di acqua?
R: Il valore della costante del prodotto di solubilità (Ksp) per Ag2SO4 può essere calcolato utilizzando le informazioni fornite, ma ciò richiede dati aggiuntivi sulla dissociazione di Ag2SO4 in acqua.
D: Qual è la massa molare di Ag2SO4?
R: La massa molare di Ag2SO4 è circa 311,81 g/mol.
D: Si forma un Ag2SO4 solido quando 2,7 g vengono sciolti in 100 ml di acqua?
R: Sì, può formarsi un po’ di Ag2SO4 solido quando supera il limite di solubilità del solfato di diargent in 100 ml di acqua.
