L’etossido di sodio è una base forte formata dalla reazione del sodio con l’etanolo. Viene utilizzato nella sintesi organica per facilitare reazioni come l’esterificazione e la deprotonazione.
| Nome IUPAC | Etossido di sodio |
| Formula molecolare | C2H5NaO |
| numero CAS | 141-52-6 |
| Sinonimi | Etanolo, sale sodico; Etossido di sodio; Sodio etilico; Etilato; Alcolato etilico di sodio |
| InChI | InChI=1S/C2H5O.Na/c1-2-3;/h2-3H,1H3;/q-1;+1 |
Proprietà dell’etossido di sodio
Formula di etossido di sodio
La formula chimica dell’etossido di sodio è C2H5NaO. È costituito da due atomi di carbonio (C), cinque atomi di idrogeno (H), un atomo di sodio (Na) e un atomo di ossigeno (O). La formula rappresenta il rapporto tra gli atomi presenti in una molecola di etossido di sodio.
Massa molare dell’etossido di sodio
La massa molare dell’etossido di sodio viene calcolata sommando le masse atomiche di tutti gli atomi nella sua formula. Il sodio (Na) ha una massa molare di 22,99 g/mol, il carbonio (C) ha una massa molare di 12,01 g/mol, l’idrogeno (H) ha una massa molare di 1,01 g/mol mol e l’ossigeno (O) ha una massa molare massa di 1,01 g/mol. massa di 16,00 g/mol. La loro aggiunta dà una massa molare di circa 68,06 g/mol per l’etossido di sodio.
Punto di ebollizione dell’etossido di sodio
L’etossido di sodio ha un punto di ebollizione di circa 90-95°C (194-203°F). Questa temperatura indica il punto in cui l’etossido di sodio cambia da una fase liquida a una fase gassosa quando riscaldato a pressione atmosferica standard.
Punto di fusione dell’etossido di sodio
Il punto di fusione dell’etossido di sodio è di circa 260-270°C (500-518°F). Ciò significa la temperatura alla quale l’etossido di sodio solido passa allo stato liquido.
Densità dell’etossido di sodio g/mL
L’etossido di sodio ha una densità di circa 0,868 g/mL. La densità si riferisce alla massa di una sostanza per unità di volume e può essere utilizzata per determinare la sua pesantezza o leggerezza relativa rispetto a un uguale volume d’acqua.
Peso molecolare dell’etossido di sodio
Il peso molecolare dell’etossido di sodio, chiamato anche peso molecolare, è di circa 68,06 g/mol. Si calcola sommando le masse atomiche di tutti gli atomi presenti in una molecola di etossido di sodio.
Struttura dell’etossido di sodio
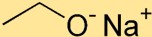
L’etossido di sodio ha una struttura in cui l’atomo di sodio (Na) è legato all’atomo di ossigeno (O) tramite un legame ionico. Il gruppo etossido, costituito da due atomi di carbonio (C) e cinque atomi di idrogeno (H), è attaccato all’atomo di sodio.
Solubilità dell’etossido di sodio
L’etossido di sodio è altamente solubile in solventi polari come l’etanolo (C2H5OH) e altri solventi organici. Si dissolve facilmente in questi solventi per formare una soluzione limpida e incolore, facilitandone l’uso come reagente in varie reazioni organiche.
| Aspetto | Solido incolore |
| Peso specifico | 0,868 g/ml |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 68,06 g/mole |
| Densità | 0,868 g/ml |
| Punto di fusione | 260-270°C (500-518°F) |
| Punto di ebollizione | 90-95°C (194-203°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce con l’acqua |
| Solubilità | Solubile in etanolo (C2H5OH) e altri solventi organici |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Base (alcalino) |
Sicurezza e pericoli dell’etossido di sodio
L’etossido di sodio presenta diversi rischi per la sicurezza e occorre prestare attenzione quando lo si maneggia. È una sostanza corrosiva che può provocare gravi ustioni alla pelle, agli occhi e al sistema respiratorio. Evitare il contatto diretto e indossare guanti, occhiali e indumenti protettivi. Reagisce violentemente con l’acqua, rilasciando gas idrogeno infiammabile e deve essere conservato lontano dall’umidità. L’etilato di sodio può anche reagire vigorosamente con l’aria, provocando potenzialmente incendi o esplosioni. Una buona ventilazione è fondamentale per prevenire l’accumulo di vapori. Inoltre, è importante maneggiare l’etossido di sodio in un laboratorio ben attrezzato con personale addestrato per ridurre al minimo i rischi e garantire la sicurezza.
| Simboli di pericolo | Corrosivo |
| Descrizione della sicurezza | – Provoca gravi ustioni<br>- Reagisce violentemente a contatto con l’acqua<br>- Conservare lontano dall’umidità<br>- Maneggiare con cura<br>- Utilizzare dispositivi di protezione<br>- Conservare in un luogo asciutto<br>- Assicurarsi buona ventilazione |
| Numeri di identificazione delle Nazioni Unite | UN2922 |
| Codice SA | 2905.19.00 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | II |
| Tossicità | Tossico se ingerito o inalato |
Metodi per la sintesi dell’etossido di sodio
Esistono diversi metodi per sintetizzare l’etossido di sodio.
Un modo per sintetizzare l’etossido di sodio prevede la reazione tra sodio metallico ed etanolo . Il sodio metallico subisce una reazione redox con l’etanolo anidro, dando luogo alla formazione di etossido di sodio. Per effettuare la reazione, si possono aggiungere piccoli pezzi di sodio metallico all’etanolo assoluto e far rifluire la miscela in condizioni controllate.
Un altro metodo prevede la reazione tra idrossido di sodio (NaOH) ed etanolo . L’idrossido di sodio viene sciolto in etanolo e la miscela viene riscaldata, il che favorisce la reazione per dare etossido di sodio. I chimici usano comunemente questo metodo quando non preferiscono la reazione diretta tra sodio metallico ed etanolo.
In alternativa, possono preparare etossido di sodio facendo reagire l’etanolo con il carbonato di sodio (Na2CO3). Sciogliere il carbonato di sodio in etanolo , quindi scaldare e mescolare la miscela. Questo processo porta alla formazione di etossido di sodio.
Va notato che questi metodi di sintesi richiedono il rigoroso rispetto delle precauzioni di sicurezza a causa della reattività delle sostanze chimiche coinvolte. La corretta manipolazione delle sostanze infiammabili, l’uso di dispositivi di protezione e lo svolgimento delle reazioni in aree ben ventilate sono essenziali per la sicurezza personale e il successo della sintesi dell’etossido di sodio.
Usi dell’etossido di sodio
L’etossido di sodio trova varie applicazioni grazie alla sua reattività e alla forte natura basica. Ecco alcuni usi comuni:
- Sintesi organica: l’etossido di sodio funge ampiamente da base solida nella sintesi organica. Facilita reazioni come i processi di esterificazione, condensazione e deprotonazione.
- Reagente alcossido: serve come reagente alcossido, che può reagire con vari composti organici per formare alcossidi. Questi alcossidi sono intermedi cruciali in molte reazioni organiche.
- Catalizzatore: l’etossido di sodio agisce come catalizzatore in diverse reazioni chimiche. Promuove la conversione di composti organici, come alcoli ed esteri, nei loro corrispondenti eteri o prodotti di esterificazione.
- Agente di disidratazione: disidrata i composti organici rimuovendo le molecole d’acqua, facilitando così la sintesi di prodotti anidri.
- Polimerizzazione: l’etossido di sodio partecipa alle reazioni di polimerizzazione, inclusa la produzione di polietilene tereftalato (PET) e altri polimeri di poliestere.
- Produzione farmaceutica: trova applicazioni nell’industria farmaceutica per la sintesi di vari composti farmaceutici tra cui esteri, eteri e intermedi.
- Produzione di biodiesel: il processo di transesterificazione utilizza l’etilato di sodio per convertire oli vegetali o grassi animali in biodiesel, un combustibile rinnovabile ed ecologico.
- Reagente di laboratorio: i ricercatori utilizzano comunemente l’etossido di sodio come reagente per reazioni organiche e in configurazioni sperimentali.
Domande:
D: È a base di etossido di sodio?
R: Sì, l’etossido di sodio è una base.
D: L’etossido di sodio è una base forte o debole?
R: L’etossido di sodio è una base forte.
D: Cosa ti aspetteresti se l’etossido di sodio fosse aggiunto all’acqua?
R: Se si aggiungesse etossido di sodio all’acqua, reagirebbe vigorosamente, rilasciando gas idrogeno e formando idrossido di sodio.
D: L’etossido di sodio è una base forte o debole?
R: L’etossido di sodio è una base forte.
D: L’etossido di sodio è un nucleofilo forte?
R: Sì, l’etossido di sodio è un forte nucleofilo.
D: Quale dei seguenti subisce più facilmente una reazione E2 con etossido di sodio?
R: Il composto con un gruppo uscente primario o secondario subirebbe più facilmente una reazione E2 con etossido di sodio.
D: L’etossido di sodio è un nucleofilo forte?
R: Sì, l’etossido di sodio è un forte nucleofilo.
D: È a base di etossido di sodio?
R: Sì, l’etossido di sodio è una base.
D: Quale dei seguenti subisce più facilmente una reazione E2 con etossido di sodio (NaOCH2CH3)?
R: Un composto con un gruppo uscente primario o secondario subirebbe più facilmente una reazione E2 con etossido di sodio.
D: L’etossido di sodio è infiammabile?
R: L’etossido di sodio in sé non è infiammabile, ma reagisce violentemente con l’acqua, rilasciando gas idrogeno infiammabile.
D: Cosa, se combinato con l’etanolo, produce etossido di sodio e idrogeno?
R: La combinazione di sodio metallico ed etanolo produce etossido di sodio e idrogeno gassoso.
D: Cosa ti aspetteresti se l’etossido di sodio fosse aggiunto all’acqua?
R: Se l’etossido di sodio venisse aggiunto all’acqua, reagirebbe vigorosamente, rilasciando gas idrogeno e formando idrossido di sodio.
