Il persolfato di ammonio ((NH4)2S2O8) è una polvere bianca. Si dissolve in acqua e rilascia ossigeno. Può sbiancare, incidere o avviare la polimerizzazione.
| Nome dell’IUPAC | Perossidisolfato di ammonio |
| Formula molecolare | (NH4)2S2O8 |
| numero CAS | 7727-54-0 |
| Sinonimi | Persolfato di ammonio, Perossodisolfato di ammonio, Persolfato di ammonio, Perossidisolfato di ammonio |
| InChI | InChI=1S/2H3N.H2O8S2/c;;1-9(2,3)7-8-10(4,5)6/h2*1H3;(H,1,2,3)(H,4,5 ,6) |
Proprietà del persolfato di ammonio
Formula di persolfato di ammonio
La formula del persolfato di ammonio è (NH4)2S2O8. È costituito da due cationi ammonio (NH4+) e un anione persolfato (S2O82-). L’anione persolfato ha due gruppi solfato (SO42-) collegati da un legame perossido (OO).
Massa molare del persolfato di ammonio
La massa molare di (NH4)2S2O8 è 228,18 g/mol. Questo si calcola sommando le masse atomiche di tutti gli atomi nella formula: 2 x 14,01 (N) + 8 x 1,01 (H) + 2 x 32,06 (S) + 8 x 16,00 (O).
Punto di ebollizione del persolfato di ammonio
(NH4)2S2O8 non ha un punto di ebollizione perché si decompone prima di raggiungere questa temperatura. Si decompone a circa 120°C (248°F) in ammoniaca, azoto, ossigeno e acqua. La reazione di decomposizione è:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Punto di fusione del persolfato di ammonio
(NH4)2S2O8 non ha punto di fusione perché si decompone prima di raggiungere questa temperatura. Si decompone a circa 120°C (248°F) in ammoniaca, azoto, ossigeno e acqua. La reazione di decomposizione è:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Densità del persolfato di ammonio g/mL
La densità di (NH4)2S2O8 è 1,98 g/mL a 25°C. Ciò significa che un millilitro di (NH4)2S2O8 pesa 1,98 grammi.
Peso molecolare del persolfato di ammonio
Il peso molecolare di (NH4)2S2O8 è uguale alla sua massa molare, che è 228,18 g/mol. Ciò significa che una mole di (NH4)2S2O8 pesa 228,18 grammi.
Struttura del persolfato di ammonio
La struttura di (NH4)2S2O8 può essere rappresentata dalla seguente struttura di Lewis:
OO
|| ||
O=S||-OOS||=O
|| ||
OO
/\
NHNH
\/
H
/\
NHNH
\/
H
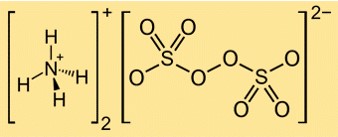
In questa struttura, ciascun atomo di zolfo è legato a quattro atomi di ossigeno in una geometria tetraedrica e ciascun atomo di ossigeno ha due coppie di elettroni liberi. Il legame perossido tra i due gruppi solfato è un legame singolo con una coppia di elettroni. I cationi di ammonio sono formati da atomi di azoto che condividono tre elettroni con tre atomi di idrogeno ciascuno e hanno una carica positiva.
Solubilità del persolfato di ammonio
(NH4)2S2O8 è molto solubile in acqua, molto più del sale di potassio associato 1 . Si dissolve in acqua per formare ioni ammonio e ioni persolfato, che possono ulteriormente dissociarsi in radicali solfati:
(NH4)2S2O8 -> 2NH4+ + S2O82-
S2O82- -> 2 SO4•-
La solubilità di (NH4)2S2O8 in acqua aumenta con l’aumentare della temperatura. A 25°C può sciogliere fino a 80g/100ml di acqua. È anche moderatamente solubile in metanolo.
| Aspetto | Cristalli da bianchi a giallastri |
| Densità specifica | 1,98 |
| Colore | Da bianco a giallastro |
| Odore | Dolce e sgradevole |
| Massa molare | 228,18 g/mole |
| Densità | 1,98 g/ml a 25°C |
| Punto di fusione | 120°C (si decompone) |
| Punto di ebollizione | N/A (scomposto) |
| Punto flash | N / A |
| solubilità in acqua | 80 g/100 ml a 25°C |
| Solubilità | Moderatamente solubile in MeOH |
| Pressione del vapore | N / A |
| Densità del vapore | N / A |
| pKa | N / A |
| pH | N / A |
Sicurezza e pericoli del persolfato di ammonio
(NH4)2S2O8 è un forte agente ossidante che può intensificare il fuoco e reagire in modo esplosivo con materiali combustibili. Può anche causare vari effetti sulla salute se ingerito, inalato o a contatto con la pelle o gli occhi. Può irritare la pelle, gli occhi, il naso, la gola e i polmoni. Può anche causare reazioni allergiche come eruzioni cutanee, asma o difficoltà respiratorie. È dannoso per la vita acquatica. Deve quindi essere maneggiato con cura e con adeguati dispositivi di protezione. Deve essere conservato lontano da fonti di calore, scintille, fiamme e qualsiasi altra sostanza incompatibile.
| Simboli di pericolo | O (ossidante), Xn (nocivo), Xi (irritante) |
| Descrizione della sicurezza | S17 (Tenere lontano da materiali combustibili), S26 (In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico), S36/37/39 (Indossare indumenti protettivi, guanti adeguati e proteggersi gli occhi/la faccia), S45 (In caso di incidente o di malessere consultare immediatamente un medico) |
| Numeri di identificazione delle Nazioni Unite | ONU 1444 |
| Codice SA | 28334000 |
| Classe di pericolo | 5.1 (Materiali ossidanti) |
| Gruppo di imballaggio | III |
| Tossicità | LD50 orale ratto: 689 mg/kg, LC50 per inalazione ratto: 2,95 mg/L/4 ore, LD50 cutanea ratto: 2000 mg/kg |
Metodi per la sintesi del persolfato di ammonio
È possibile utilizzare vari metodi per preparare (NH4)2S2O8, che è un sale inorganico.
Uno dei metodi più comuni prevede l’elettrolisi di una soluzione fredda e concentrata di solfato di ammonio ((NH4)2SO4) e acido solforico (H2SO4) .
Questo metodo è stato descritto per la prima volta da Hugh Marshall. L’elettrolisi prevede il passaggio di una corrente elettrica attraverso la soluzione utilizzando un anodo di platino e un catodo d’argento poroso.
All’anodo, l’elettrolisi dell’acido solforico produce ioni idrogeno solfato HSO4-, che si combinano con l’acqua per creare ioni persolfato S2O82- e idrogeno gassoso H2. Al catodo, l’ossigeno gassoso O2 subisce una riduzione per produrre perossido di idrogeno H2O2, che reagisce con gli ioni ammonio NH4+ per formare (NH4)2S2O8 (NH4)2S2O8 e acqua H2O.
La reazione complessiva è la seguente:
(NH4)2SO4 + 2 H2SO4 -> (NH4)2S2O8 + 2 H2O + H2 + O2
Raffreddando e filtrando, (NH4)2S2O8 può essere cristallizzato dalla soluzione elettrolitica.
Un altro metodo per preparare (NH4)2S2O8 è l’ossidazione del bisolfato di ammonio NH4HSO4 con ozono O3 o perossido di idrogeno H2O2 . Questo metodo produce una resa e una purezza di (NH4)2S2O8 più elevate rispetto al metodo dell’elettrolisi. La reazione è:
NH4HSO4 + O3 -> (NH4)2S2O8 + H2O
Oro
NH4HSO4 + H2O2 -> (NH4)2S2O8 + 2H2O
Usi del persolfato di ammonio
(NH4)2S2O8 è una sostanza chimica versatile che ha molti usi in vari settori e applicazioni. Alcuni degli usi più comuni sono:
- Serve come agente sbiancante e precursore chimico nella sintesi di altri composti importanti dal punto di vista industriale.
- Avvia il processo di polimerizzazione e i produttori lo utilizzano principalmente nella produzione di polistirolo.
- I produttori di PCB lo utilizzano come agente mordenzante per rimuovere il rame e altri metalli dalla superficie.
- L’industria dei semiconduttori utilizza anche (NH4)2S2O8 come agente chimico per pulire e lucidare i wafer di silicio.
- I laboratori lo utilizzano come agente detergente e disinfettante per attrezzature, vetreria e sistemi idrici.
- Previene l’imbrunimento di frutta e verdura, rendendolo un additivo utilizzato per conservare gli alimenti.
- Varie reazioni chimiche lo utilizzano come agente ossidante per la sintesi di perossidi organici, solfoni e sulfamidici.
- Le batterie lo utilizzano come depolarizzatore per aumentarne le prestazioni e la durata.
- Le decoloranti per capelli lo usano come ingrediente comune per schiarire il colore dei capelli ossidando il pigmento della melanina.
Domande:
D: Quanto dura il persolfato di ammonio?
R: (NH4)2S2O8 è un composto stabile che può essere conservato a tempo indeterminato allo stato solido senza decomposizione. Tuttavia, se disciolto in acqua, potrebbe perdere la sua efficacia nel tempo. La durata di conservazione di una soluzione al 10% di (NH4)2S2O8 è di circa 2-4 settimane a temperatura ambiente e di 2-3 mesi a 4°C 1 2 . La soluzione deve essere protetta dalla luce e dal calore e controllata periodicamente per la presenza di bolle o precipitati che indicano decomposizione.
D: Cosa fa il persolfato di ammonio?
R: (NH4)2S2O8 è un forte agente ossidante che può rilasciare radicali dell’ossigeno in soluzione acquosa. Questi radicali possono innescare o accelerare varie reazioni chimiche, come polimerizzazione, sbiancamento, mordenzatura, pulizia e disinfezione. (NH4)2S2O8 può anche fungere da fonte di ioni solfato per la sintesi di altri composti.
D: In cosa mescolare il persolfato di ammonio?
R: (NH4)2S2O8 è altamente solubile in acqua e può essere miscelato con acqua per preparare soluzioni a diverse concentrazioni. La solubilità di (NH4)2S2O8 in acqua aumenta con l’aumentare della temperatura. A 25°C può sciogliere fino a 80g/100ml di acqua. È anche moderatamente solubile in metanolo. (NH4)2S2O8 non deve essere miscelato con sostanze incompatibili, come materiali combustibili, agenti riducenti, metalli, acidi o basi, poiché potrebbe reagire violentemente o in modo esplosivo con essi.
D: Il perossidisolfato di ammonio è uguale al persolfato di ammonio?
R: Sì, il perossidisolfato di ammonio è un altro nome per (NH4)2S2O8. Sono entrambi sinonimi dello stesso composto con la formula (NH4)2S2O8.
D: A cosa serve il persolfato di ammonio in SDS-PAGE?
R: SDS-PAGE (elettroforesi su gel di poliacrilammide con sodio dodecil solfato) è una tecnica per separare le proteine in base alla loro dimensione e carica. (NH4)2S2O8 viene utilizzato come catalizzatore per la polimerizzazione dei monomeri di acrilammide e bisacrilammide per formare una matrice di gel di poliacrilammide. (NH4)2S2O8 genera radicali liberi che avviano la reazione di reticolazione tra i monomeri.
D: Come produrre il persolfato di ammonio al 10%?
R: Per preparare una soluzione al 10% di (NH4)2S2O8, pesare 10 g di (NH4)2S2O8 solido e scioglierlo in 90 ml di acqua distillata. Mescolare fino a completa dissoluzione e trasferire in un matraccio tarato da 100 ml. Riempire fino al segno con acqua distillata e mescolare bene. Conservare la soluzione in una bottiglia scura a 4°C o a temperatura ambiente.
D: Come posso riparare un persolfato di ammonio innescato dall’arco?
R: Un arco elettrico è un difetto causato da un arco elettrico che danneggia la superficie di un metallo. Ciò può ridurre la robustezza e la resistenza alla corrosione del metallo e portare a fessurazioni o guasti. Per riparare un arco elettrico, un metodo consiste nell’utilizzare (NH4)2S2O8 come mordenzante per rimuovere l’area interessata. La procedura è la seguente:
- Pulisci la superficie metallica con acetone o alcool per rimuovere eventuali tracce di sporco o grasso.
- Applicare uno strato sottile di soluzione di persolfato di ammonio (10-20%) sull’area colpita dall’arco utilizzando un pennello o un batuffolo di cotone.
- Attendere 5-10 minuti finché non compaiono bolle sulla superficie, indicando che è in atto una reazione di ossidazione.
- Sciacquare la superficie con acqua e asciugare con un panno pulito.
- Ripetere il processo fino alla completa eliminazione dell’arco.
- Ispezionare la superficie per individuare eventuali crepe o cavità e riempirle con materiale di riempimento appropriato, se necessario.
- Applicare un rivestimento protettivo o una vernice per prevenire ulteriore corrosione.
D: Il persolfato di ammonio è un tensioattivo?
R: No, (NH4)2S2O8 non è un tensioattivo. Un tensioattivo è una sostanza che riduce la tensione superficiale di un liquido o tra due liquidi e può formare micelle o emulsioni. (NH4)2S2O8 non ha queste proprietà. È un agente ossidante che può rilasciare radicali dell’ossigeno in soluzione acquosa.
D: Quali aspetti del tuo esperimento sono controllati da TEMED e dal persolfato di ammonio?
R: TEMED e (NH4)2S2O8 vengono utilizzati per controllare la polimerizzazione dei monomeri di acrilammide e bisacrilammide per formare una matrice di gel di poliacrilammide per l’elettroforesi. TEMED e (NH4)2S2O8 agiscono come catalizzatori che generano radicali liberi che avviano e accelerano la reazione di reticolazione tra i monomeri. La concentrazione e il rapporto di TEMED e (NH4)2S2O8 influenzano la velocità e la completezza della polimerizzazione, nonché la dimensione dei pori e la resistenza meccanica del gel.
D: Il persolfato di ammonio reagisce con l’aria?
R: Sì, (NH4)2S2O8 può reagire con l’aria, soprattutto in condizioni umide. (NH4)2S2O8 può assorbire l’umidità dall’aria e subire idrolisi, formando solfato di ammonio e perossido di idrogeno. Il perossido di idrogeno può ulteriormente scomporsi in acqua e ossigeno, rilasciando calore e pressione. Ciò potrebbe causare la rottura o l’esplosione del contenitore (NH4)2S2O8 se non è adeguatamente ventilato. (NH4)2S2O8 può anche reagire con l’ossigeno presente nell’aria per formare ozono, che è un gas tossico. Pertanto, (NH4)2S2O8 deve essere conservato in un’area fresca, asciutta e ben ventilata, lontano da fonti di calore, scintille, fiamme e altre sostanze incompatibili.
