Il perossido di potassio (K2O2) è un composto fatto di potassio e ossigeno. Viene spesso utilizzato come forte agente ossidante nelle industrie e nei laboratori per facilitare varie reazioni chimiche.
| Nome IUPAC | Perossiossidanide di potassio |
| Formula molecolare | K2O2 |
| numero CAS | 17014-71-0 |
| Sinonimi | Superossido di potassio; Biossido di dipotassio; Biossido di potassio; Ossido di perpotassio |
| InChI | InChI=1S/2K.O2/c;;1-2/q2*+1;-2 |
Proprietà del perossido di potassio
Formula di perossido di potassio
La formula chimica del perossido di potassio è K2O2. Questa formula rappresenta il numero e il tipo di atomi presenti nella molecola. La formula è importante per identificare la sostanza e comprenderne le proprietà chimiche.
Massa molare del perossido di potassio
La massa molare di K2O2 è 110,2 g/mol. Ciò significa che una mole di K2O2 pesa 110,2 grammi. La massa molare è una proprietà importante di una sostanza perché consente di calcolare la quantità di sostanza presente in una determinata massa o volume.
Punto di ebollizione del perossido di potassio
K2O2 non ha un punto di ebollizione specifico, perché si decompone prima di raggiungere il punto di ebollizione. Ad alte temperature, K2O2 si decompone in ossido di potassio e ossigeno gassoso. Pertanto, generalmente non viene utilizzato in applicazioni ad alta temperatura.
Punto di fusione del perossido di potassio
Il punto di fusione di K2O2 è 655°C. Questo elevato punto di fusione lo rende un agente ossidante adatto nelle reazioni ad alta temperatura. Tuttavia, è importante notare che potrebbe decomporsi prima di raggiungere il punto di fusione se esposto a temperature o umidità elevate.
Densità del perossido di potassio g/mL
La densità di K2O2 è 2,08 g/mL. Questa alta densità lo rende un solido denso che affonda nell’acqua. La densità di K2O2 è importante anche per determinare la sua solubilità in vari solventi.
Peso molecolare del perossido di potassio
Il peso molecolare di K2O2 è 110,2 g/mol. Questo valore è la somma dei pesi atomici di tutti gli atomi presenti nella molecola. Il peso molecolare è una proprietà importante utilizzata per calcolare varie proprietà di una sostanza, comprese la sua massa molare e la sua densità.
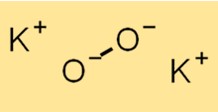
Struttura del perossido di potassio
La struttura di K2O2 è composta da un catione K+ e un anione O2^2-. L’anione O2^2- è costituito da due atomi di ossigeno legati insieme in modo covalente. La struttura di K2O2 è essenziale per comprenderne le proprietà chimiche e la reattività.
| Aspetto | Solido da bianco a giallo pallido |
| Peso specifico | 2.08 |
| Colore | Da bianco a giallo pallido |
| Odore | Inodore |
| Massa molare | 110,2 g/mole |
| Densità | 2,08 g/ml |
| Punto di fusione | 655°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce con l’acqua |
| Solubilità | Insolubile nei solventi organici |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli del perossido di potassio
K2O2 presenta diversi rischi per la sicurezza a causa delle sue forti proprietà ossidanti. Può reagire vigorosamente con l’acqua o l’umidità, rilasciando gas ossigeno e generando calore. Questa reazione può potenzialmente causare un incendio o un’esplosione se non gestita correttamente. Inoltre, può causare irritazione alla pelle e agli occhi al contatto e l’inalazione della sua polvere può causare problemi respiratori. È importante maneggiare K2O2 con attenzione, indossando adeguati dispositivi di protezione individuale e conservandolo in un luogo fresco e asciutto, lontano da fonti di calore e materiali incompatibili. In caso di esposizione accidentale, consultare immediatamente un medico.
| Simboli di pericolo | Agente ossidante |
| Descrizione della sicurezza | Non esporre all’acqua. Indossare guanti protettivi e proteggere gli occhi/il viso. Conservare in luogo fresco e asciutto, lontano da fonti di calore e materiali incompatibili. |
| Numeri di identificazione delle Nazioni Unite | UN1504 |
| Codice SA | 2829.90.90 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | Può causare irritazione alla pelle e agli occhi. L’inalazione di polvere può causare problemi respiratori. |
Metodi di sintesi del perossido di potassio
Esistono diversi metodi per sintetizzare K2O2, inclusa la reazione dell’idrossido di potassio con perossido di idrogeno , la reazione dell’idrossido di potassio con perossido di bario e la decomposizione termica del superossido di potassio.
Il primo metodo prevede l’aggiunta lenta di idrossido di potassio a una soluzione di perossido di idrogeno mescolando fino a formare un precipitato bianco di K2O2. Il processo prevede il filtraggio della miscela e il lavaggio del solido con acqua fredda per rimuovere le impurità.
Nel secondo metodo, mescolare una sospensione di perossido di bario aggiungendo una soluzione di idrossido di potassio . Filtrare la miscela ed evaporare il filtrato a secchezza. Quindi riscaldare il solido risultante ad alta temperatura per decomporre l’eventuale perossido di bario rimanente e formare K2O2.
Il terzo metodo prevede il riscaldamento del superossido di potassio ad alta temperatura, provocandone la decomposizione in K2O2 e ossigeno gassoso.
Usi del perossido di potassio
K2O2 ha diversi usi in vari settori grazie alle sue proprietà ossidanti. Alcuni dei suoi usi includono:
- Candeggina: utilizzata come agente sbiancante per prodotti tessili e di carta, nonché per prodotti sbiancanti per capelli e denti.
- Fonte di ossigeno: utilizzata come fonte di ossigeno in sistemi chiusi, come nei sottomarini, dove può rilasciare ossigeno se miscelato con acqua.
- Polimerizzazione: utilizzato nella polimerizzazione di alcuni monomeri per produrre polimeri, come nella sintesi del polistirene.
- Bonifica del suolo: utilizzato per la bonifica del suolo per rimuovere contaminanti organici, come le fuoriuscite di petrolio.
- Chimica analitica: utilizzato in chimica analitica come agente ossidante per determinare la presenza di determinati composti.
- Carburante per missili: utilizzato come ossidante nel carburante per missili grazie alla sua capacità di rilasciare ossigeno.
- Sintesi chimica: utilizzato nella sintesi di vari composti organici e inorganici, come la sintesi del permanganato di potassio.
Domande:
D: Cos’è meglio, il perossido di idrogeno o l’idrossido di potassio?
R: Dipende dall’uso previsto. Il perossido di idrogeno è un potente agente ossidante ed è comunemente usato come disinfettante, candeggina e sbiancante per capelli e denti. L’idrossido di potassio, invece, è una base forte ed è comunemente utilizzato nella produzione di saponi e detergenti, nonché nella produzione di biodiesel da oli vegetali.
D: Quali sono le formule chimiche del superossido di potassio, del perossido di potassio e dell’ossido di potassio?
R: Le formule chimiche sono K2O2 per superossido di potassio, K2O2 per perossido di potassio e K2O per ossido di potassio.
D: Cosa si forma quando il perossido di idrogeno reagisce con lo ioduro e lo iodato di potassio?
R: Quando il perossido di idrogeno reagisce con ioduro e iodato di potassio, lo iodio viene prodotto secondo la seguente reazione: H2O2 + KI + KIO3 → I2 + K2O + H2O.
D: Qual è il numero di ossidazione dell’atomo di ossigeno in K2O2?
R: Il numero di ossidazione dell’atomo di ossigeno in K2O2 è -1.
D: Qual è il numero di ossidazione del K in K2O2?
R: Il numero di ossidazione di K in K2O2 è +1.
