Il perossido di magnesio (MgO2) è un composto costituito da magnesio e ossigeno. È comunemente usato in agricoltura come fonte di ossigeno a lento rilascio e come ammendante del terreno per migliorare la crescita delle piante.
| Nome IUPAC | Perossido di magnesio |
| Formula molecolare | MgO2 |
| numero CAS | 14452-57-4 |
| Sinonimi | Biossido di magnesio, magnesio; perossido, Permag, Magics, Oxy-Gen, EINECS 215-217-9 |
| InChI | InChI=1S/Mg.2O2/h;2*1H/q+2;;/p-2 |
Proprietà del perossido di magnesio
Formula di perossido di magnesio
La formula chimica del perossido di magnesio è MgO2. Ciò significa che una molecola di perossido di magnesio contiene un atomo di magnesio e due atomi di ossigeno. La formula è importante perché identifica il tipo e il numero di atomi presenti nel composto e aiuta a determinare la stechiometria delle reazioni chimiche che coinvolgono il perossido di magnesio.
Massa molare del perossido di magnesio
MgO2 ha una massa molare di 56.304 g/mol. Ciò significa che una mole di MgO2 contiene 56.304 grammi del composto. La massa molare è una proprietà importante di MgO2 perché aiuta a determinare la quantità di sostanza necessaria per le reazioni chimiche.
Punto di ebollizione del perossido di magnesio
L’MgO2 non ha un punto di ebollizione fisso perché si decompone prima di poter bollire. Quando riscaldato, si decompone in ossido di magnesio e ossigeno gassoso. Questa proprietà di MgO2 lo rende utile come fonte di ossigeno in varie applicazioni.
Punto di fusione del perossido di magnesio
MgO2 ha un punto di fusione di 223°C. Ciò significa che a temperature superiori a 700°C il composto solido si trasforma in liquido. Il punto di fusione è una proprietà importante dell’MgO2 perché determina il comportamento del composto quando esposto ad alte temperature.
Densità del perossido di magnesio g/mL
La densità di MgO2 è 2,41 g/mL. Ciò significa che un millilitro di MgO2 pesa 2,41 grammi. La densità è una proprietà importante dell’MgO2 perché aiuta a determinare la massa di un dato volume del composto.
Peso molecolare del perossido di magnesio
Il peso molecolare di MgO2 è 56,304 g/mol. Ciò significa che una molecola di MgO2 ha una massa di 56.304 unità di massa atomica. Il peso molecolare è una proprietà importante dell’MgO2 perché aiuta a determinare la quantità di sostanza necessaria per le reazioni chimiche.
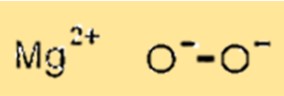
Struttura del perossido di magnesio
MgO2 ha una struttura cristallina con ioni magnesio che occupano i siti ottaedrici della struttura reticolare e ioni ossigeno che occupano i siti tetraedrici. Questa struttura cristallina è importante perché determina le proprietà fisiche e chimiche di MgO2.
| Proprietà | Valore |
| Aspetto | polvere bianca |
| Peso specifico | 3,15 g/cm³ |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 56,304 g/mole |
| Densità | 2,41 g/ml |
| Punto di fusione | 223°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Insolubile |
| Solubilità | Solubile negli acidi |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli del perossido di magnesio
L’MgO2 è generalmente considerato sicuro se maneggiato e utilizzato correttamente. Tuttavia, può essere irritante per la pelle, gli occhi e il sistema respiratorio. L’ingestione di grandi quantità può causare irritazione gastrointestinale, vomito e diarrea. È importante evitare di inalare la polvere e indossare indumenti e attrezzature protettive durante la manipolazione. L’MgO2 non è né infiammabile né esplosivo, ma può reagire con alcune sostanze chimiche come acidi e forti ossidanti. Sono necessarie una conservazione e una manipolazione adeguate per evitare reazioni accidentali. Se esposto o ingerito, consultare immediatamente un medico.
| Simboli di pericolo | Oh, Xi |
| Descrizione della sicurezza | Il perossido di magnesio può causare irritazione alla pelle e agli occhi, nonché irritazione del tratto respiratorio se inalato. Potrebbe essere nocivo se ingerito o a contatto con la pelle e può causare gravi lesioni oculari. Esiste anche il rischio di incendio se esposto a calore, fiamme o ossidanti. |
| Numeri di identificazione delle Nazioni Unite | UN1479 |
| Codice SA | 282910 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | Il perossido di magnesio può causare irritazione alla pelle e agli occhi, nonché irritazione del tratto respiratorio se inalato. Potrebbe essere nocivo se ingerito o a contatto con la pelle e può causare gravi lesioni oculari. Esiste anche il rischio di incendio se esposto a calore, fiamme o ossidanti. |
Metodi di sintesi del perossido di magnesio
Esistono diversi metodi per sintetizzare MgO2, ciascuno con i suoi vantaggi e svantaggi.
Un metodo prevede la reazione tra MgO e perossido di idrogeno . In questo metodo, si mescola MgO con una piccola quantità di acqua per formare una pasta, quindi si aggiunge il perossido di idrogeno mescolando la miscela. Il prodotto risultante è MgO2 e acqua.
Un altro metodo prevede la reazione tra Mg(OH)2 e perossido di idrogeno . Il chimico scioglie Mg(OH)2 in acqua per formare una soluzione, quindi mescola la miscela aggiungendo lentamente il perossido di idrogeno . Il prodotto risultante è MgO2 e acqua.
Un terzo metodo prevede la reazione diretta tra magnesio metallico e ossigeno gassoso ad alte temperature. Questo metodo richiede attrezzature specializzate e non è comunemente usato come altri metodi.
Usi del perossido di magnesio
MgO2 ha vari usi in vari settori, tra cui:
- Applicazioni ambientali – Utilizzato come composto che rilascia ossigeno nella bonifica del suolo e delle acque sotterranee per abbattere gli inquinanti.
- Agricoltura – Utilizzato come fertilizzante e ammendante grazie alle sue proprietà di ossigeno a lento rilascio che migliorano la crescita delle piante.
- Medico – Utilizzato in alcune formulazioni di dentifricio come agente sbiancante e ossigenante per la salute orale.
- Produzione chimica – Utilizzato nella produzione di prodotti chimici speciali come resine epossidiche, peracidi e peresteri.
- Lavorazione degli alimenti – Utilizzato come agente sbiancante nella farina e in altri prodotti alimentari.
- Industria tessile – Utilizzato come agente sbiancante nella produzione tessile.
- Trattamento dell’acqua – Utilizzato per purificare l’acqua rilasciando ossigeno e abbattendo i composti organici.
Domande:
D: A cosa serve il perossido di magnesio?
R: L’MgO2 viene utilizzato in vari settori, come applicazioni ambientali, agricoltura, settore medico, produzione chimica, trasformazione alimentare, industria tessile e trattamento delle acque.
D: Quali sono i prodotti quando si mescolano perossido di idrogeno e solfato di magnesio?
R: Quando H2O2 e solfato di magnesio vengono miscelati, i prodotti formati sono MgO2, acqua e ossigeno gassoso.
D: Il perossido di magnesio viene utilizzato nei laboratori?
R: Sì, MgO2 viene utilizzato nei laboratori per vari scopi come reazioni chimiche, trattamento dell’acqua e igiene ambientale.
D: Il magnesio scompone il perossido di idrogeno?
R: Il magnesio non scompone l’H2O2 da solo. Tuttavia, il magnesio può reagire con H2O2 in presenza di un catalizzatore, come lo ioduro di potassio, per rilasciare gas ossigeno.
D: Quale delle seguenti non è un’unità formula corretta? k2o mgo2 al2o3 sro
R: Mgo2 non è un’unità di formula corretta. L’unità di formula corretta per l’ossido di magnesio è MgO.
D: Quali sono i prodotti di questa reazione combinata? mgo + co2 mgo3 + c mgco3 mgo2 mgo + o2 co2 + o2
R: Il prodotto formato nella reazione combinata di mgo e co2 è mgco3.
D: Mgo2 liquido, gassoso o solido?
R: Mgo2 è un composto solido.
