Il permanganato di potassio (KMnO4) è un composto cristallino viola utilizzato per una varietà di scopi, come la disinfezione dell’acqua, il trattamento delle malattie della pelle e come reagente di laboratorio. Può anche essere usato come potente agente ossidante.
| Nome IUPAC | Permanganato di Potassio |
| Formula molecolare | KMnO4 |
| numero CAS | 7722-64-7 |
| Sinonimi | Permanganato di potassio, cristalli di Condy, minerale camaleonte, ipermangan, Kalium hypermanganicum |
| InChI | InChI=1S/K.Mn.4O/q+1;;;;-1 |
Proprietà del permanganato di potassio
Formula di permanganato di potassio
La formula chimica del permanganato di potassio è KMnO4. È costituito da uno ione potassio (K+), uno ione manganese (MnO4^-) e quattro atomi di ossigeno (O). La formula indica il tipo e il numero di atomi che compongono il composto. Viene utilizzato per scrivere equazioni chimiche e per calcolare la massa e il numero di atomi presenti in una determinata quantità di sostanza.
Massa molare del permanganato di potassio
KMnO4 ha una massa molare di 158.034 g/mol. Ciò significa che una mole di KMnO4, che equivale a 6.022 x 10^23 molecole, ha una massa di 158.034 grammi. La massa molare di un composto si calcola sommando le masse atomiche di tutti gli elementi presenti nel composto. Nel caso di KMnO4, la massa molare si calcola sommando le masse atomiche di potassio, manganese e ossigeno.
Punto di ebollizione del permanganato di potassio
KMnO4 non ha un punto di ebollizione definito perché si decompone prima di raggiungere il punto di ebollizione. A pressione atmosferica, KMnO4 inizia a decomporsi intorno ai 240°C. Quando riscaldato, rilascia prima ossigeno e forma manganato di potassio, che poi si decompone in ossido di potassio e ossido di manganese.
Punto di fusione del permanganato di potassio
KMnO4 ha un punto di fusione elevato di 240°C. Ciò significa che a temperature inferiori a 240°C, KMnO4 esisterà allo stato solido. Quando riscaldato, KMnO4 subisce una serie di cambiamenti chimici, tra cui il rilascio di ossigeno e la formazione di diversi ossidi di manganese.
Densità del permanganato di potassio g/ml
La densità di KMnO4 è 2,703 g/mL a temperatura ambiente. Ciò significa che un millilitro di KMnO4 pesa 2.703 grammi. La densità di una sostanza è il rapporto tra la sua massa e il suo volume. Nel caso del KMnO4, la sua elevata densità lo rende utile per separarlo da altre sostanze mediante filtrazione.
Peso molecolare del permanganato di potassio
Il peso molecolare di KMnO4 è 158,034 g/mol. Questo valore rappresenta la massa media di una molecola di KMnO4. Si calcola sommando le masse atomiche di potassio, manganese e ossigeno che compongono il composto.
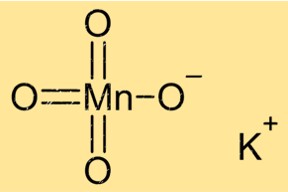
Struttura del permanganato di potassio
KMnO4 ha una struttura cristallina con un sistema cristallino monoclino. I suoi cristalli sono di colore viola e hanno una forma prismatica. Il composto ha una geometria di coordinazione ottaedrica, con sei atomi di ossigeno che circondano l’atomo centrale di manganese. Gli ioni di potassio si trovano tra strati di manganese e atomi di ossigeno.
| Aspetto | Solido cristallino viola scuro |
| Peso specifico | 2.703 g/cm³ |
| Colore | Viola scuro |
| Odore | Inodore |
| Massa molare | 158.034 g/mole |
| Densità | 2.703 g/cm³ |
| Punto di fusione | 240°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | 6,38 g/l a 20°C |
| Solubilità | Solubile in acqua, etanolo, acetone |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 2.17 |
| pH | 7,2 – 8,9 (soluzione all’1%) |
Sicurezza e pericoli del permanganato di potassio
KMnO4 può essere pericoloso se non maneggiato correttamente. È un forte agente ossidante che può reagire violentemente con agenti riducenti, composti organici e altri prodotti chimici. Può causare irritazione alla pelle e agli occhi e può essere nocivo se ingerito o inalato. Il composto può anche macchiare la pelle e gli indumenti. È necessario adottare adeguate precauzioni di sicurezza durante la manipolazione di KMnO4, incluso indossare indumenti protettivi, occhiali e guanti. Deve essere conservato in un’area fresca, asciutta e ben ventilata, lontano da materiali incompatibili. Se esposto o ingerito, consultare immediatamente un medico.
| Simboli di pericolo | O, Xn |
| Descrizione della sicurezza | S22, S26, S36/37/39, S45 |
| Numeri di identificazione delle Nazioni Unite | ONU 1490 |
| Codice SA | 28416100 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | Tossico se ingerito o inalato. Può causare irritazione alla pelle e agli occhi. |
Metodi per la sintesi del permanganato di potassio
Vari metodi possono sintetizzare KMnO4.
Un metodo prevede la reazione del biossido di manganese con idrossido di potassio e un agente ossidante, come il cloro o il perossido di idrogeno.
Un altro metodo prevede la reazione del manganato di potassio con il cloro gassoso.
Ancora un altro metodo prevede la reazione dell’idrossido di potassio con il biossido di manganese e quindi l’ossidazione della miscela risultante con un agente ossidante.
Il processo di sintesi solitamente comporta il riscaldamento dei reagenti ad una temperatura specifica e il mantenimento della temperatura per un certo tempo. Il processo consiste nel filtrare la miscela risultante e ottenere KMnO4 mediante cristallizzazione.
Usi del permanganato di potassio
KMnO4 ha vari usi in diversi settori grazie alle sue forti proprietà ossidanti. Ecco alcuni usi comuni di KMnO4:
- Trattamento dell’acqua: Utilizzato per trattare l’acqua per scopi civili e industriali, in quanto può rimuovere le impurità ed eliminare gli odori sgradevoli.
- Applicazioni mediche: usato localmente per trattare le condizioni della pelle (eczema, dermatiti e infezioni fungine).
- Uso di laboratorio: utilizzato come agente ossidante in vari esperimenti di laboratorio e come colorante in biologia per evidenziare cellule e tessuti.
- Agricoltura: utilizzato come fungicida e battericida per proteggere le colture da parassiti e malattie dannose.
- Chimica: utilizzato in chimica analitica per determinare la concentrazione di alcune sostanze chimiche e in chimica organica come reagente nelle reazioni chimiche.
- Antincendio: utilizzato come ritardante di fiamma e per estinguere alcuni tipi di incendi.
- Applicazioni industriali: utilizzato nella produzione di prodotti chimici, tessili e batterie.
Domande:
D: Quale gas viene rilasciato quando il permanganato di potassio viene scomposto?
R: Quando KMnO4 viene scomposto, viene rilasciato ossigeno gassoso (O2).
D: Cos’è il permanganato di potassio?
R: Il permanganato di potassio è un potente agente ossidante con la formula chimica KMnO4.
D: Qual è la formula chimica del permanganato di potassio?
R: La formula chimica del permanganato di potassio è KMnO4.
D: Dove acquistare cristalli di permanganato di potassio?
R: I cristalli KMnO4 possono essere acquistati da fornitori di prodotti chimici, società di forniture di laboratorio e rivenditori online.
D: Cos’è KMnO4?
R: KMnO4 è la formula chimica del permanganato di potassio.
D: Qual è il numero di ossidazione del manganese in KMnO4?
R: Il numero di ossidazione del manganese in KMnO4 è +7.
D: Qual è il numero di ossidazione dell’ossigeno in KMnO4?
R: Il numero di ossidazione dell’ossigeno in KMnO4 è -2.
D: Quante moli ci sono in 25,0 grammi di KMnO4?
R: Per calcolare il numero di moli presenti in 25,0 grammi di KMnO4, dobbiamo dividere la massa data per la massa molare di KMnO4. La massa molare di KMnO4 è 158,034 g/mol. Pertanto, in 25,0 grammi ci sono circa 0,158 moli di KMnO4.
