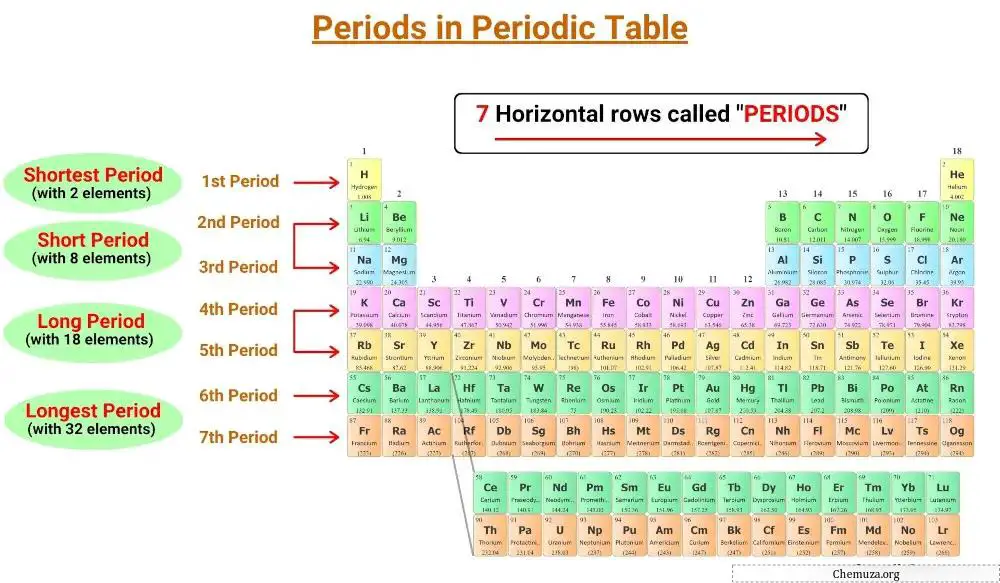
Le linee orizzontali della tavola periodica sono chiamate periodi e nella tavola periodica ci sono 7 periodi.
Gli elementi situati nello stesso periodo hanno lo stesso numero di strati elettronici.
Esploriamo ulteriormente i periodi della tavola periodica.
Cosa sono i periodi nella tavola periodica?
Nella tavola periodica i punti sono le linee che si estendono orizzontalmente da sinistra a destra.
La tavola periodica è organizzata in modo tale che gli elementi con proprietà simili sono raggruppati in colonne chiamate gruppi o famiglie, mentre gli elementi dello stesso periodo hanno lo stesso numero di gusci elettronici.
Ci sono sette periodi nella tavola periodica, numerati da 1 a 7. [1]
Numero di shell di un elemento e relativo numero di periodo
Il numero di gusci di un elemento determina il suo periodo nella tavola periodica.
Ad esempio, gli elementi del periodo 1 hanno un solo guscio elettronico, mentre gli elementi del periodo 2 hanno due gusci elettronici e così via.
Questa organizzazione aiuta i chimici a prevedere le proprietà di un elemento in base alla sua posizione nella tavola periodica.
Caratteristiche degli elementi nei periodi
Mentre ci si sposta attraverso un periodo della tavola periodica, diverse caratteristiche degli elementi cambiano in modi prevedibili. Ciò è dovuto alle tendenze periodiche osservate nelle proprietà degli elementi.
Raggio atomico:
Muovendosi da sinistra a destra in un periodo, il raggio atomico generalmente diminuisce. [2]
Questo perché il numero di protoni nel nucleo aumenta, provocando una maggiore attrazione tra il nucleo e gli elettroni al livello energetico più esterno. Ciò si traduce in un raggio atomico più piccolo.
Elettronegatività:
L’elettronegatività è la misura della capacità di un atomo di attrarre verso di sé gli elettroni in un legame chimico.
Quando ci si sposta da sinistra a destra in un periodo, l’elettronegatività generalmente aumenta. [3]
Questo perché il raggio atomico è più piccolo e la carica positiva del nucleo è più forte, rendendolo più attraente per gli elettroni caricati negativamente.
Energia ionizzata:
L’energia di ionizzazione è la quantità di energia necessaria per rimuovere un elettrone da un atomo.
Muovendosi da sinistra a destra in un periodo, l’energia di ionizzazione generalmente aumenta. [4]
Questo perché il raggio atomico è più piccolo e gli elettroni sono trattenuti più strettamente dal nucleo, rendendo più difficile la rimozione di un elettrone.
Altre caratteristiche:
Punti di fusione ed ebollizione: generalmente aumentano da sinistra a destra in un periodo, ma con alcune eccezioni.
Carattere metallico: diminuisce da sinistra a destra nel corso di un periodo, man mano che i non metalli diventano più prevalenti.
Reattività: gli elementi diventano meno reattivi man mano che ci si sposta da sinistra a destra in un periodo, perché gli elettroni sono trattenuti più strettamente e hanno meno probabilità di partecipare alle reazioni chimiche.
Importanza dei periodi in chimica
I periodi della tavola periodica sono essenziali per comprendere il comportamento degli elementi perché forniscono informazioni sulla configurazione elettronica degli elementi e su come interagiscono con altri elementi. Ecco alcuni motivi per cui i periodi sono importanti in chimica:
- Prevedere le proprietà: la tavola periodica consente agli scienziati di prevedere le proprietà degli elementi in base alla loro posizione nella tabella. Ad esempio, gli elementi dello stesso periodo hanno lo stesso numero di gusci elettronici, il che può aiutare a prevederne la dimensione atomica, la reattività e altre proprietà.
- Identificare le tendenze: la disposizione degli elementi nella tavola periodica consente agli scienziati di identificare le tendenze nelle loro proprietà. Ad esempio, l’elettronegatività e l’energia di ionizzazione tendono ad aumentare da sinistra a destra in un periodo, mentre la dimensione atomica tende a diminuire. Queste informazioni possono essere utilizzate per fare previsioni su come si comportano gli elementi nelle reazioni chimiche.
- Raggruppamento di elementi: la tavola periodica raggruppa gli elementi in categorie in base alle loro proprietà, come metalli, non metalli e metalloidi . Ciò aiuta gli scienziati a comprendere le somiglianze e le differenze tra gli elementi e il modo in cui interagiscono tra loro.
- Alla scoperta di nuovi elementi: la tavola periodica aiuta anche gli scienziati a prevedere l’esistenza e le proprietà di nuovi elementi. Esaminando le lacune nella tabella, gli scienziati possono prevedere le proprietà degli elementi da scoprire e ricercarli in laboratorio.
Riepilogo
La tavola periodica ha sette linee orizzontali chiamate periodi. Gli elementi dello stesso periodo hanno lo stesso numero di strati elettronici. Ci sono sette periodi nella tavola periodica, numerati da 1 a 7, e il numero di gusci di un elemento ne determina il periodo.
Man mano che si attraversa un periodo della tavola periodica, il raggio atomico generalmente diminuisce, mentre l’elettronegatività e l’energia di ionizzazione generalmente aumentano. Anche altre caratteristiche, come i punti di fusione e di ebollizione, il carattere metallico e la reattività, cambiano in modo prevedibile nel corso del tempo.
I periodi della tavola periodica sono importanti per prevedere le proprietà degli elementi, identificare tendenze, raggruppare elementi e scoprire nuovi elementi. Esaminando le lacune nella tabella, gli scienziati possono prevedere le proprietà degli elementi da scoprire e ricercarli in laboratorio.
