Il perclorato di potassio (KClO4) è un composto che contiene potassio, cloro e ossigeno. È comunemente usato in articoli pirotecnici ed esplosivi grazie alle sue proprietà ossidanti.
| Nome dell’IUPAC | Perclorato di potassio |
| Formula molecolare | KClO4 |
| numero CAS | 7778-74-7 |
| Sinonimi | Percal K, Perclorato di potassio, Clorato di potassio (VII), ONU 1489 |
| InChI | InChI=1S/ClHO4.K/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Proprietà del perclorato di potassio
Formula di perclorato di potassio
Il perclorato di potassio ha una formula chimica KClO4, che indica che contiene un atomo di potassio, un atomo di cloro e quattro atomi di ossigeno. Il composto è un sale inorganico altamente solubile in acqua, il che lo rende un utile ossidante in molte applicazioni.
Massa molare del perclorato di potassio
La massa molare di KClO4 si calcola sommando le masse atomiche degli elementi costitutivi del composto. Le masse atomiche di potassio, cloro e ossigeno sono rispettivamente 39,10 g/mol, 35,45 g/mol e 16,00 g/mol. Quindi, la massa molare di KClO4 è 138,55 g/mol.
Punto di ebollizione del perclorato di potassio
KClO4 non ha un punto di ebollizione definito poiché si decompone prima di raggiungere un punto di ebollizione. Quando riscaldato a temperature elevate, KClO4 si decompone in cloruro di potassio e ossigeno gassoso. È stato tuttavia osservato che il composto può sublimare a temperature comprese tra 400 e 500 °C.
Perclorato di potassio Punto di fusione
Il punto di fusione di KClO4 è di circa 610°C. A questa temperatura il composto solido si trasforma nello stato liquido. L’elevato punto di fusione del KClO4 lo rende adatto all’uso in varie applicazioni industriali.
Densità del perclorato di potassio g/mL
La densità di KClO4 è di circa 2,52 g/cm³ a temperatura ambiente. Ciò indica che il composto è più denso dell’acqua, che ha una densità di 1 g/cm³. L’elevata densità di KClO4 lo rende un efficace ossidante nella pirotecnica.
Peso molecolare del perclorato di potassio
Il peso molecolare di KClO4 è 138,55 g/mol. Questo valore viene determinato sommando le masse atomiche degli elementi costitutivi del composto. Il peso molecolare di KClO4 è utile per determinare la massa del composto necessario per una particolare reazione o processo.
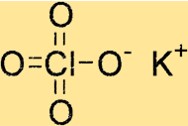
Struttura del perclorato di potassio
KClO4 ha una struttura cristallina tetragonale, il che significa che ha una simmetria quadrupla attorno al suo asse c. Il reticolo cristallino del composto è formato da ioni potassio, ioni cloro e ioni ossigeno, tenuti insieme da legami ionici.
Solubilità del perclorato di potassio
KClO4 è altamente solubile in acqua, con una solubilità di circa 4,5 g/mL a temperatura ambiente. Il composto è solubile anche in altri solventi polari come etanolo e acetone. Tuttavia, è insolubile in solventi non polari come benzene e cloroformio. La solubilità del KClO4 è un fattore importante nel suo utilizzo come ossidante in varie applicazioni industriali.
| Aspetto | Solido cristallino bianco |
| Densità specifica | 2.52 |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 138,55 g/mole |
| Densità | 2,52 g/cm³ |
| Punto di fusione | 610°C |
| Punto di ebollizione | Si decompone prima del punto di ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | 4,5 g/ml a 25°C |
| Solubilità | Solubile in etanolo e acetone, insolubile in benzene e cloroformio |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Neutro |
Sicurezza e pericoli del perclorato di potassio
Il KClO4 può comportare rischi per la sicurezza se non maneggiato correttamente. Il composto è un forte ossidante e può reagire con materiali combustibili provocando incendi o esplosioni. L’inalazione di polvere o vapori di KClO4 può anche causare irritazione al sistema respiratorio. L’esposizione prolungata al composto può provocare irritazione della pelle o dermatite. Quando si maneggia KClO4, è importante utilizzare dispositivi di protezione individuale adeguati come guanti, occhiali di sicurezza e respiratori. Il composto deve inoltre essere conservato in un luogo fresco e asciutto, lontano da materiali incompatibili e fonti di calore e ignizione.
| Simboli di pericolo | Ossidante |
| Descrizione della sicurezza | Tenere lontano da materiali combustibili. Indossare adeguati dispositivi di protezione individuale. Evitare di respirare polvere o fumi. |
| Numeri di identificazione delle Nazioni Unite | UN1489 |
| Codice SA | 2829.90.90 |
| Classe di pericolo | 5.1 – Sostanze ossidanti |
| Gruppo di imballaggio | II |
| Tossicità | Può causare irritazione alla pelle o dermatiti in caso di esposizione prolungata. L’ingestione o l’inalazione del composto può causare irritazione respiratoria. |
Metodi per la sintesi del perclorato di potassio
KClO4 può essere sintetizzato con vari metodi.
Un metodo comune consiste nel far reagire il clorato di potassio con il perclorato di bario. La reazione produce KClO4 e cloruro di bario come sottoprodotto, che può essere filtrato.
Un altro metodo prevede la reazione del clorato di potassio con acido cloridrico e cloruro di sodio. La reazione produce KClO4 e clorato di sodio, che possono essere separati mediante cristallizzazione.
La reazione tra idrossido di potassio e perclorato di ammonio può anche sintetizzare KClO4. La reazione produce KClO4 e idrossido di ammonio, che possono essere separati mediante filtrazione.
Un altro metodo prevede la reazione del cloruro di potassio con perclorato di sodio in presenza di un catalizzatore. La reazione produce KClO4 e cloruro di sodio, che possono essere separati mediante cristallizzazione.
Usi del perclorato di potassio
KClO4 ha vari usi in diversi settori. Alcuni dei suoi usi comuni sono:
- Pirotecnica: un agente ossidante popolare nell’industria pirotecnica. Utilizzato nella fabbricazione di fuochi d’artificio, razzi e altri tipi di esplosivi.
- Eliche per razzi: utilizzate come ossidante nella produzione di propellenti per razzi. Comunemente utilizzato nei razzi a propellente solido e nei lanci degli Space Shuttle.
- Iniziatori airbag: utilizzati come iniziatori nella produzione di airbag. Per attivare un airbag, una carica elettrica viene inviata attraverso un filo rivestito di KClO4. Ciò provoca una reazione che produce gas azoto, che gonfia l’airbag.
- Fiammiferi: Utilizzati nella produzione di fiammiferi di sicurezza. Per produrre un composto combustibile che si accende quando colpisce una superficie ruvida, viene miscelato con solfuro di antimonio e zolfo.
- Galvanotecnica: utilizzato nell’industria galvanica come componente degli elettroliti utilizzati per la galvanoplastica dei metalli.
- Medicina: utilizzato nel trattamento delle condizioni della tiroide come l’ipertiroidismo. Tuttavia, il suo utilizzo in medicina è diminuito a causa di problemi di sicurezza.
- Chimica analitica: utilizzato anche come reagente in chimica analitica per la determinazione di alcune sostanze.
Domande:
D: Quali tipi di legami sono contenuti in una molecola di perclorato di potassio?
R: KClO4 contiene sia legami ionici che covalenti. Lo ione K+ e lo ione ClO4- sono tenuti insieme da legami ionici, mentre lo ione perclorato stesso contiene sia legami covalenti che ionici.
D: Qual è la formula del perclorato di potassio?
R: KClO4.
D: Il perclorato di potassio è acquoso?
R: Il KClO4 può dissolversi nell’acqua, rendendola acquosa in determinate condizioni.
D: A cosa serve il perclorato di potassio?
R: Il KClO4 ha varie applicazioni, tra cui fuochi d’artificio, razzi e dispositivi di gonfiaggio degli airbag. Viene anche utilizzato in chimica analitica come reagente e agente ossidante.
D: Come preparare la polvere flash senza perclorato di potassio?
R: La polvere flash può essere prodotta senza KClO4 utilizzando ossidanti alternativi, come perclorato di ammonio, perclorato di sodio o perossido di bario.
D: Qual è lo stato di ossidazione di un singolo atomo di cloro in KClO4?
R: Lo stato di ossidazione del singolo atomo di cloro in KClO4 è +7.
D: KClO4 è solubile in acqua?
R: Sì, KClO4 è solubile in acqua.
D: KClO4 è un acido o una base?
R: KClO4 non è né un acido né una base. È un sale composto da un metallo (potassio) e uno ione poliatomico (perclorato).
