Il pentacloruro di fosforo è un composto chimico con la formula PCl5. Viene utilizzato come reagente in varie reazioni chimiche. Reagisce vigorosamente con l’acqua, liberando gas di acido cloridrico.
| Nome IUPAC | Pentacloruro di fosforo |
| Formula molecolare | PCl5 |
| numero CAS | 10026-13-8 |
| Sinonimi | Pentaclorofosforano, cloruro di fosforo (V), cloruro di fosforo, cloruro di fosforo (V). |
| InChI | InChI=1S/Cl5P/c1-6(2,3,4)5 |
Proprietà del pentacloruro di fosforo
Formula del pentacloruro di fosforo
La formula del pentacloruro di fosforo è PCl5. È costituito da un atomo di fosforo legato a cinque atomi di cloro. La formula rappresenta il rapporto degli atomi nel composto.
Massa molare del pentacloruro di fosforo
La massa molare del cloruro di fosforo (V) si calcola sommando le masse atomiche di tutti i suoi elementi costitutivi. Il fosforo ha una massa molare di circa 30,97 grammi per mole e ciascun atomo di cloro ha una massa molare di circa 35,45 grammi per mole. La loro aggiunta dà una massa molare di circa 208,24 grammi per mole per il cloruro di fosforo (V).
Punto di ebollizione del pentacloruro di fosforo
Il cloruro di fosforo (V) ha un punto di ebollizione di circa 167,8 gradi Celsius. A questa temperatura il composto subisce un cambiamento di fase da liquido a gassoso. Il punto di ebollizione è influenzato dalle forze intermolecolari presenti nel composto.
Pentacloruro di fosforo Punto di fusione
Il punto di fusione del cloruro di fosforo (V) è di circa -93,6 gradi Celsius. Questa è la temperatura alla quale il composto passa dallo stato solido a quello liquido. Il punto di fusione è una proprietà importante nel determinare il comportamento fisico del composto.
Densità del pentacloruro di fosforo g/mL
La densità del cloruro di fosforo (V) è di circa 2,1 grammi per millilitro. La densità rappresenta la massa di una sostanza per unità di volume. La densità del cloruro di fosforo (V) aiuta a comprenderne la disposizione e la compattezza delle sue particelle.
Peso molecolare del pentacloruro di fosforo
Il peso molecolare del cloruro di fosforo (V) è di circa 208,24 grammi per mole. È la somma dei pesi atomici di tutti gli atomi presenti nel composto. Il peso molecolare è utile in vari calcoli, come determinare la quantità di sostanza in una determinata massa o volume.
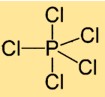
Struttura del pentacloruro di fosforo
Il cloruro di fosforo (V) ha una struttura molecolare in cui un atomo di fosforo è circondato da cinque atomi di cloro. Gli atomi di cloro sono disposti simmetricamente attorno all’atomo centrale di fosforo, formando una geometria bipiramidale trigonale.
Solubilità del pentacloruro di fosforo
Il cloruro di fosforo (V) è scarsamente solubile in acqua. Reagisce vigorosamente con l’acqua, liberando gas di acido cloridrico. Tuttavia, si dissolve facilmente in solventi polari come benzene e tetracloruro di carbonio. La solubilità del cloruro di fosforo (V) è influenzata dalla polarità e dalle proprietà chimiche del solvente.
| Aspetto | Cristalli incolori |
| Peso specifico | 2,1 g/ml |
| Colore | Incolore |
| Odore | Acri |
| Massa molare | 208,24 g/mole |
| Densità | 2,1 g/ml |
| Punto di fusione | -93,6°C |
| Punto di ebollizione | 167,8°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce vigorosamente |
| Solubilità | Solubile in solventi polari come benzene e tetracloruro di carbonio |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Non applicabile |
Sicurezza e pericoli del pentacloruro di fosforo
Il cloruro di fosforo (V) comporta diversi rischi per la sicurezza. È corrosivo e può causare gravi ustioni alla pelle, agli occhi e al sistema respiratorio al contatto. L’inalazione dei suoi fumi o polveri può causare irritazioni e danni respiratori. Il composto reagisce violentemente con l’acqua, liberando gas tossico di acido cloridrico. È anche molto reattivo con i materiali organici, causando potenzialmente incendi o esplosioni. È necessario adottare precauzioni adeguate quando si maneggia il cloruro di fosforo (V), compreso l’uso di dispositivi di protezione come guanti, occhiali e un respiratore. Dovrebbe essere conservato e maneggiato in un’area ben ventilata, lontano da sostanze incompatibili, per prevenire incidenti e ridurre al minimo i rischi.
| Simboli di pericolo | Corrosivo |
| Descrizione della sicurezza | Maniglia con cauzione. Utilizzare dispositivi di protezione adeguati. |
| Numeri di identificazione delle Nazioni Unite | ONU1806 |
| Codice SA | 2812.20.00 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | II (Pericolo moderato) |
| Tossicità | Tossico per ingestione o inalazione. Può causare grave irritazione. |
Metodi di sintesi del pentacloruro di fosforo
Vari metodi consentono la sintesi del cloruro di fosforo (V). Un metodo comune prevede la reazione tra tricloruro di fosforo (PCl3) e cloro gassoso (Cl2) . In questo processo, il recipiente di reazione combina sia i composti che il calore oppure un catalizzatore come il ferro avvia la reazione. Il gas di cloro agisce come un agente ossidante, convertendo PCl3 in PCl5. La reazione procede come segue:
PCl3 + Cl2 → PCl5
Un altro metodo per sintetizzare il cloruro di fosforo (V) prevede la reazione tra fosforo e cloro gassoso. Questo metodo è più diretto e prevede la seguente reazione:
P4 + 10Cl2 → 4PCl5
In questa reazione, il fosforo e il cloro gassoso reagiscono in condizioni appropriate, dando luogo alla formazione di cloruro di fosforo (V).
È importante notare che entrambi i metodi di sintesi richiedono un’attenta manipolazione e adeguate precauzioni di sicurezza. Le reazioni coinvolgono sostanze altamente reattive e corrosive, pertanto sono necessari dispositivi di protezione e ventilazione adeguata. Inoltre, è essenziale eseguire queste reazioni in un ambiente controllato per prevenire incidenti e garantire la sicurezza del personale coinvolto.
Usi del pentacloruro di fosforo
Il cloruro di fosforo (V) trova varie applicazioni grazie alle sue proprietà e reattività uniche. Ecco alcuni dei suoi usi:
- Sintesi chimica: la sintesi organica utilizza ampiamente il cloruro di fosforo (V) come reagente per convertire gli acidi carbossilici in cloruri acidi e gli alcoli in cloruri alchilici.
- Prodotti farmaceutici: la sintesi di composti farmaceutici, inclusi antibiotici e coloranti, si basa fortemente sul cloruro di fosforo (V) come intermedio chiave.
- Catalizzatore: il cloruro di fosforo (V) catalizza diverse reazioni chimiche, come l’acilazione di Friedel-Crafts e il riarrangiamento di Beckmann.
- Industria dei polimeri: la produzione di vari polimeri, tra cui polivinilcloruro (PVC) e policarbonati, utilizza cloruro di fosforo (V) come agente clorurante.
- Applicazioni di laboratorio: nelle applicazioni di laboratorio, il cloruro di fosforo (V) agisce come agente essiccante per rimuovere tracce di acqua dagli apparecchi di laboratorio e come agente clorurante e disidratante in varie reazioni.
- Erbicidi e pesticidi: la produzione di erbicidi e pesticidi per controllare la crescita delle erbe infestanti ed eliminare i parassiti comporta l’uso di cloruro di fosforo (V).
- Agenti per la guerra chimica: storicamente, il cloruro di fosforo (V) ha contribuito attivamente alla produzione di agenti per la guerra chimica, ma il suo utilizzo per tali scopi è ora soggetto a rigide normative e restrizioni.
- Trattamento della superficie metallica: i processi di trattamento della superficie metallica utilizzano cloruro di fosforo (V) per migliorare le proprietà di adesione e promuovere la resistenza alla corrosione.
- Ritardanti di fiamma: la produzione di additivi ritardanti di fiamma per tessuti, plastica e altri materiali incorpora cloruro di fosforo (V).
- Produzione farmaceutica: il cloruro di fosforo (V) trova applicazioni nella produzione di vari prodotti farmaceutici, inclusa la sintesi di vitamine e derivati ormonali.
È importante maneggiare il cloruro di fosforo (V) con cura e seguire protocolli di sicurezza adeguati a causa della sua natura corrosiva e dei potenziali rischi per la salute.
Domande:
D: Qual è la formula corretta per il pentacloruro di fosforo?
R: La formula corretta per il cloruro di fosforo (V) è PCl5.
D: Qual è la formula molecolare del pentacloruro di fosforo?
R: La formula molecolare del cloruro di fosforo (V) è PCl5.
D: Quale massa di pentacloruro di fosforo verrebbe prodotta dalla reazione completa di 15,2 g di P4?
R: La massa di cloruro di fosforo (V) prodotta sarebbe di circa 208,24 g.
D: Qual è la forma del pentacloruro di fosforo?
R: La forma del cloruro di fosforo (V) è bipiramidale trigonale.
D: Qual è la massa di una molecola di pentacloruro di fosforo?
R: La massa di una molecola di cloruro di fosforo (V) è di circa 208,24 grammi per mole.
D: Proprietà del pentacloruro di fosforo?
R: Il cloruro di fosforo (V) è corrosivo, reagisce violentemente con l’acqua e viene utilizzato come reagente nella sintesi chimica.
D: Angoli di legame del cloruro di fosforo (V)?
R: Gli angoli di legame nel pentacloruro di fosforo sono circa 120 gradi (tra atomi di cloro equatoriali) e 90 gradi (tra atomi di cloro assiali).
D: Come produrre il pentacloruro di fosforo?
R: Il cloruro di fosforo (V) può essere prodotto facendo reagire il tricloruro di fosforo (PCl3) con cloro gassoso (Cl2) o mediante reazione diretta tra fosforo e cloro gassoso.
D: Qual è la geometria elettronica del fosforo nel pentacloruro di fosforo?
A: La geometria elettronica del fosforo nel cloruro di fosforo (V) è bipiramidale trigonale.
