L’ossido di potassio (K2O) è un composto chimico composto da due atomi di potassio e un atomo di ossigeno. È comunemente usato nella produzione di fertilizzanti grazie al suo alto contenuto di potassio.
| Nome IUPAC | Ossido di potassio |
| Formula molecolare | K2O |
| numero CAS | 12136-45-7 |
| Sinonimi | Potassa, ossido di dipotassio, monossido di potassio |
| InChI | InChI=1S/2K.O |
Proprietà dell’ossido di potassio
Formula di ossido di potassio
La formula dell’ossido di potassio è K2O. Ciò significa che ciascuna molecola di K2O contiene due atomi di K e un atomo di O. La formula dell’ossido di potassio è importante nei calcoli chimici, come la determinazione della massa molare e della stechiometria del composto nelle reazioni chimiche.
Massa molare dell’ossido di potassio
K2O ha una massa molare di 94,2 g/mol. Ciò significa che una mole di K2O contiene 94,2 grammi del composto. La massa molare di un composto è importante in molti calcoli chimici, come determinare la quantità di composto necessaria per una reazione o la massa di un campione del composto.
Punto di ebollizione dell’ossido di potassio
K2O ha un punto di ebollizione elevato di 3.150 ° C (5.720 ° F). Questo alto punto di ebollizione è dovuto ai forti legami ionici tra gli atomi di potassio e di ossigeno del composto. K2O è un solido a temperatura e pressione ambiente, ma a temperature molto elevate può essere vaporizzato in un gas.
Punto di fusione dell’ossido di potassio
Il punto di fusione del K2O è 740°C (1.364°F). Ciò significa che a temperature superiori a 740°C, il K2O si scioglie e diventa liquido. Il punto di fusione del K2O è relativamente alto rispetto ad altri composti ionici, come il cloruro di sodio (801°C) e l’ossido di magnesio (2852°C).
Densità dell’ossido di potassio g/ml
La densità di K2O è 2,32 g/cm³. Questa densità è maggiore di quella dell’acqua (1 g/cm³) e indica che K2O è un composto relativamente denso. L’elevata densità di K2O è dovuta alla vicinanza degli atomi di potassio e ossigeno nella struttura reticolare cristallina del composto.
Peso molecolare dell’ossido di potassio
Il peso molecolare di K2O è 94,2 g/mol. Il peso molecolare è la somma dei pesi atomici di tutti gli atomi presenti in una molecola del composto. Il peso molecolare di K2O è importante nei calcoli stechiometrici, come la determinazione della quantità di reagenti necessari per una reazione chimica.
Struttura dell’ossido di potassio
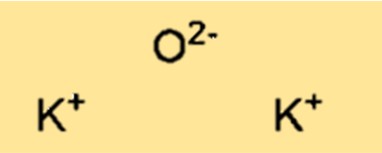
K2O ha una struttura reticolare cristallina. La struttura è costituita da cationi potassio (K+) e anioni ossido (O2-) disposti secondo uno schema ripetitivo tridimensionale. La struttura del reticolo cristallino del K2O è importante nel determinare le proprietà fisiche e chimiche del composto.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2.32 |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 94,2 g/mole |
| Densità | 2,32 g/cm³ |
| Punto di fusione | 740°C (1364°F) |
| Punto di ebollizione | 3.150°C (5.720°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce violentemente con l’acqua |
| Solubilità | Insolubile nei solventi organici |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli dell’ossido di potassio
K2O presenta diversi rischi e pericoli per la sicurezza. Reagisce violentemente con l’acqua, liberando una grande quantità di calore e producendo idrossido di potassio. Questa reazione può causare ustioni e incendi, quindi è importante maneggiare K2O con cura. L’inalazione o l’ingestione di K2O può causare irritazione alle vie respiratorie, agli occhi e alla pelle. Inoltre, l’elevata temperatura richiesta per sciogliere o vaporizzare K2O può creare pericolo di ustioni o incendi. Pertanto, quando si maneggia K2O è necessario indossare dispositivi di protezione adeguati, inclusi guanti, occhiali e un respiratore, per ridurre al minimo questi rischi.
| Simboli di pericolo | Ossidante, Corrosivo |
| Descrizione della sicurezza | Tenere lontano dall’acqua, non inalare, indossare dispositivi di protezione |
| Numeri di identificazione delle Nazioni Unite | ONU 2257 |
| Codice SA | 2815.20 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | Corrosivo per la pelle e gli occhi, l’inalazione può causare irritazione delle vie respiratorie |
Metodi di sintesi dell’ossido di potassio
Vari metodi possono sintetizzare K2O.
Un metodo comune consiste nel riscaldare il carbonato di potassio, K2CO3 , ad alte temperature in presenza di ossigeno. Questo processo produce K2O, anidride carbonica e vapore acqueo.
Un altro metodo prevede la reazione del potassio metallico con l’ossigeno gassoso, producendo K2O e rilasciando una grande quantità di calore nel processo.
Una reazione tra KOH e un ossido metallico, come l’ossido di rame o l’ossido di ferro, può produrre K2O. La reazione produce il corrispondente idrossido metallico e K2O.
Il potassio metallico reagisce con l’acqua per produrre idrossido di potassio e idrogeno gassoso, determinando la sintesi di K2O. La disidratazione dell’idrossido di potassio porta alla formazione di K2O.
Nei metodi di deposizione chimica in fase vapore, il reattore ad alta temperatura introduce un gas contenente potassio e ossigeno per sintetizzare K2O. Il gas subisce una reazione chimica per produrre K2O, che si deposita sulla superficie del substrato.
Usi dell’ossido di potassio
K2O ha molti usi in diversi settori grazie alle sue proprietà chimiche e fisiche. Ecco alcuni usi comuni di K2O:
- Produzione di fertilizzanti: un elemento importante nella produzione di fertilizzanti. Aiuta le piante a crescere e a mantenere la loro salute.
- Produzione del vetro: utilizzato nella produzione del vetro per ridurre la temperatura di fusione e migliorare la resistenza meccanica del vetro.
- Metallurgia: utilizzato in metallurgia per produrre metalli come titanio e alluminio. Ciò aiuta a rimuovere le impurità e a migliorare la qualità complessiva del prodotto finale.
- Industria petrolifera: utilizzato nell’industria petrolifera come catalizzatore nella produzione di metanolo e altri prodotti chimici.
- Batterie: i produttori di batterie utilizzano K2O come elettrolita nella produzione di batterie, in particolare batterie alcaline.
- Essiccante: è un potente essiccante. Utilizzato per rimuovere l’umidità da materiali, come solventi, combustibili e gas.
- Reagente di laboratorio: utilizzato anche come reagente di laboratorio per varie reazioni e processi chimici.
Domande:
D: Qual è la formula chimica dell’ossido di potassio?
R: La formula chimica dell’ossido di potassio è K2O.
D: Qual è la formula dell’ossido di potassio?
R: La formula dell’ossido di potassio è K2O.
D: L’ossido di potassio è solubile in acqua?
R: Sì, K2O è solubile in acqua, sebbene reagisca vigorosamente con l’acqua per produrre idrossido di potassio.
D: Quanti grammi di permanganato di potassio sono necessari per ossidare completamente 2 g di toluene?
R: Il numero di grammi di permanganato di potassio necessari per ossidare completamente 2 g di toluene dipende dalle condizioni di reazione e dalla stechiometria. Sono necessarie un’equazione bilanciata e condizioni di reazione per determinare la quantità di permanganato di potassio richiesta.
D: K2O è ionico o covalente?
R: K2O è un composto ionico composto da cationi K+ e anioni O2-.
D: Cos’è K2O?
R: K2O è la formula chimica dell’ossido di potassio, un composto ionico con molte applicazioni industriali.
D: Che tipo di obbligazione è K2O?
R: Il legame tra potassio e ossigeno in K2O è ionico.
