L’ossido di ammonio ((NH4)2O) è un composto cristallino bianco solubile in acqua e agisce come una base debole. È prodotto dalla reazione di ammoniaca e ossigeno e viene utilizzato nei fertilizzanti, nei detergenti e come estintore.
| Nome IUPAC | Ossido di ammonio |
| Formula molecolare | (NH4)2O |
| numero CAS | 12046-03-6 |
| Sinonimi | Idrossido di ammonio, soluzione di ammoniaca, Aqua Ammonia |
| InChI | InChI=1S/H4N.O/h1H4;/q+1;-1 |
Proprietà dell’ossido di ammonio
Formula di ossido di ammonio
La formula dell’ossido di ammonio è (NH4)2O. È un composto composto da un atomo di azoto e quattro atomi di idrogeno combinati con un atomo di ossigeno.
Massa molare dell’ossido di ammonio
La massa molare dell’ossido di ammonio è di circa 52,07 grammi per mole. Si calcola sommando i pesi atomici di tutti gli atomi presenti nella molecola. La massa molare aiuta a determinare il numero di particelle presenti in una determinata quantità di una sostanza.
Punto di ebollizione dell’ossido di ammonio
Il punto di ebollizione di (NH4)2O è di circa 90°C. È la temperatura alla quale la pressione del vapore di un liquido eguaglia la pressione attorno ad esso, facendo sì che il liquido si trasformi in un gas. Il punto di ebollizione di una sostanza è un’importante proprietà fisica che può essere utilizzata per identificare e distinguere diversi composti.
Punto di fusione dell’ossido di ammonio
Il punto di fusione di (NH4)2O è di circa -6°C. Questa è la temperatura alla quale un solido si trasforma in un liquido. Il punto di fusione di una sostanza può essere utilizzato per identificare e distinguere diversi composti, nonché per determinare la purezza di una sostanza.
Densità dell’ossido di ammonio g/ml
La densità di (NH4)2O è di circa 1,02 g/ml. La densità è la quantità di massa per unità di volume ed è una proprietà fisica fondamentale di una sostanza. La densità di una sostanza può essere utilizzata per identificare e distinguere diversi composti, nonché per determinare la purezza di una sostanza.
Peso molecolare dell’ossido di ammonio
Il peso molecolare dell’ossido di ammonio è di circa 52,07 g/mol. È la somma dei pesi atomici di tutti gli atomi presenti in una molecola della sostanza. Il peso molecolare può essere utilizzato per calcolare le moli di una sostanza presente in una data massa ed è un’importante proprietà fisica utilizzata in molti campi della scienza.
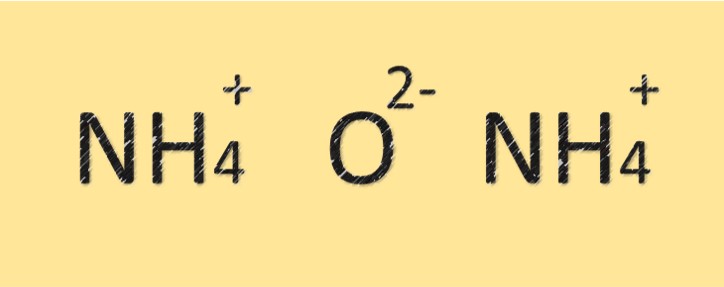
Struttura dell’ossido di ammonio
L’ossido di ammonio è un composto costituito da atomi di azoto e ossigeno. Ha una formula molecolare di (NH4)2O ed è composto da due atomi di azoto e un atomo di ossigeno. L’atomo di azoto è legato all’atomo di ossigeno da un legame covalente e ha anche una carica positiva. Il composto ha carattere basico o alcalino per la presenza dello ione ammonio.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 1,02 g/cm³ |
| Colore | Bianco |
| Odore | Ammoniaca |
| Massa molare | 52,07 g/mole |
| Densità | 1,02 g/cm³ |
| Punto di fusione | -6°C |
| Punto di ebollizione | 90°C |
| Punto flash | N / A |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua |
| Pressione del vapore | N / A |
| Densità del vapore | N / A |
| pKa | N / A |
| pH | 11,6 (100 g/L, H2O, 20°C) |
Sicurezza e pericoli dell’ossido di ammonio
(NH4)2O è irritante per gli occhi, la pelle e il sistema respiratorio. L’inalazione dei suoi vapori può provocare tosse, mancanza di respiro e irritazione ai polmoni. Il contatto con la pelle può provocare prurito e arrossamento. Il composto deve essere maneggiato con cautela e devono essere utilizzate misure protettive come guanti e protezione per gli occhi. Se esposte, le aree interessate devono essere risciacquate con acqua e consultare un medico se i sintomi persistono. È anche infiammabile e deve essere tenuto lontano da fonti di ignizione.
| Simboli di pericolo | Irritante |
| Descrizione della sicurezza | S26-S36/37/39 |
| Numeri di identificazione delle Nazioni Unite | UN2672 |
| Codice SA | 2841.90.90 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | III |
| Tossicità | Irritante per gli occhi, la pelle e il sistema respiratorio |
Metodi per la sintesi dell’ossido di ammonio
(NH4)2O può essere sintetizzato con diversi metodi, inclusa la decomposizione termica del nitrato di ammonio e la reazione tra gas di ammoniaca e gas di ossigeno.
Un metodo prevede la decomposizione termica del nitrato di ammonio, che è un fertilizzante comune. La reazione produce ammoniaca e biossido di azoto, che vengono poi ossidati in biossido di azoto e ossido nitrico. L’ossido nitrico reagisce con più gas di ammoniaca per formare (NH4)2O.
Un altro metodo prevede il passaggio del gas di ammoniaca su un catalizzatore riscaldato, facendo sì che gli atomi di azoto e ossigeno si combinino e formino (NH4)2O. Entrambi questi metodi producono (NH4)2O come un solido cristallino bianco, che può essere purificato mediante ricristallizzazione.
Usi dell’ossido di ammonio
Le industrie utilizzano (NH4)2O per vari scopi a causa del suo elevato contenuto di ammonio e delle forti proprietà alcaline. Come fertilizzante, fornisce una fonte di azoto per le piante. I detergenti lo usano per sciogliere grasso e sporco. L’industria metallurgica lo utilizza come agente riducente per gli ossidi metallici, in particolare nella produzione dell’alluminio. Come refrigerante, viene utilizzato nei sistemi di raffreddamento industriali e come fonte di azoto nella produzione di acido nitrico. In laboratorio, i chimici lo utilizzano come fonte di ammoniaca per le reazioni chimiche. La versatilità di (NH4)2O lo rende un prodotto chimico prezioso con molteplici applicazioni in tutti i settori.
