Il nitrito di sodio (NaNO2) è un composto chimico comunemente usato come conservante alimentare per prevenire la crescita batterica e migliorare il colore e il sapore dei salumi come pancetta e hot dog.
| Nome IUPAC | Nitrato di sodio |
| Formula molecolare | NaNO2 |
| numero CAS | 7632-00-0 |
| Sinonimi | Acido nitroso, sale sodico; E250; nitrito di sodio; Nitrato di sodio; Nitrito di sodio; ONU 1500 |
| InChI | InChI=1S/NO2.Na/c2-1-3;/q-1;+1 |
Proprietà del nitrito di sodio
Formula del nitrito di sodio
La formula chimica del nitrito di sodio è NaNO2. Ciò indica che una mole di nitrito di sodio contiene un catione di sodio, un atomo di azoto e due atomi di ossigeno. La formula viene utilizzata per rappresentare la composizione di una sostanza e può essere utilizzata per prevedere le reazioni che una sostanza può subire.
Massa molare del nitrito di sodio
NaNo2 ha una massa molare di 69,0 g/mol. Questa è la massa di una mole di NaNo2, ovvero la quantità di sostanza contenente 6,02 x 10^23 molecole individuali del composto. La massa molare è un’importante proprietà fisica utilizzata per calcolare varie proprietà chimiche e fisiche di una sostanza.
Punto di ebollizione del nitrito di sodio
Il punto di ebollizione di NaNo2 è 320°C (608°F). Questa è la temperatura alla quale NaNo2 cambierà da liquido a gas. Il punto di ebollizione è una proprietà importante perché può influenzare il modo in cui una sostanza viene utilizzata in varie applicazioni industriali, come la produzione di coloranti, pigmenti e prodotti farmaceutici.
Nitrito di sodio Punto di fusione
Il punto di fusione di NaNo2 è 271°C (520°F). Questa è la temperatura alla quale NaNo2 cambierà da solido a liquido. Il punto di fusione è una proprietà importante perché può influenzare la stabilità e la reattività di una sostanza a diverse temperature.
Densità del nitrito di sodio g/mL
La densità di NaNo2 è 2,168 g/mL. La densità è la massa per unità di volume di una sostanza e può essere utilizzata per determinare la concentrazione di una soluzione. La densità di NaNo2 può essere utilizzata anche per determinare la purezza di un campione.
Peso molecolare del nitrito di sodio
Il peso molecolare di NaNo2 è 69,0 g/mol. È la somma dei pesi atomici di tutti gli atomi presenti in una molecola del composto. Il peso molecolare è una proprietà importante utilizzata per calcolare varie proprietà chimiche e fisiche di una sostanza.
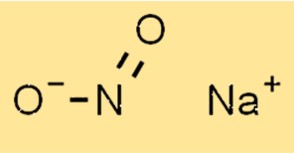
Struttura del nitrito di sodio
La struttura di NaNo2 è composta da un catione sodio (Na+) e un anione nitrito (NO2-). L’anione nitrito ha una geometria planare trigonale con un atomo di azoto e due atomi di ossigeno. Il catione sodio si trova al centro dell’anione nitrito.
Solubilità del nitrito di sodio
NaNo2 è solubile in acqua, con una solubilità di 820 g/L a 20°C. La solubilità è la quantità massima di una sostanza che può essere disciolta in una data quantità di solvente ad una data temperatura. La solubilità di NaNo2 può essere influenzata da fattori quali la temperatura e la presenza di altri soluti.
| Aspetto | Polvere cristallina da bianca a leggermente giallastra |
| Peso specifico | 2.168 g/ml |
| Colore | Da bianco a leggermente giallastro |
| Odore | Inodore |
| Massa molare | 69,0 g/mole |
| Densità | 2.168 g/ml |
| Punto di fusione | 271°C (520°F) |
| Punto di ebollizione | 320°C (608°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | 820 g/l a 20°C |
| Solubilità | Solubile in etanolo e glicerolo |
| Pressione del vapore | 1,33 kPa a 20°C |
| Densità del vapore | 2.3 (aria = 1) |
| pKa | 3.34 |
| pH | 7-8 (soluzione al 10%) |
Sicurezza e pericoli del nitrito di sodio
NaNo2 può comportare una serie di rischi per la salute umana e l’ambiente. È considerato tossico se ingerito, inalato o assorbito attraverso la pelle e può causare metaemoglobinemia, una condizione in cui il sangue non è in grado di trasportare ossigeno ai tessuti del corpo. NaNo2 può anche essere irritante per gli occhi, la pelle e il sistema respiratorio. È importante maneggiare NaNo2 con cautela, utilizzando dispositivi di protezione individuale adeguati e seguendo le corrette procedure di manipolazione e smaltimento. Inoltre, NaNo2 può rappresentare un rischio per l’ambiente se non adeguatamente contenuto e smaltito.
| Simboli di pericolo | T+, C |
| Descrizione della sicurezza | Tenere lontano da materiali combustibili. Non respirare la polvere/i fumi/i gas/la nebbia/i vapori/gli aerosol. Indossare guanti/indumenti protettivi e proteggere gli occhi/il viso. In caso di incendio: utilizzare CO2, polvere chimica o schiuma per estinguere. Smaltire il contenuto/contenitore in conformità con le normative locali/regionali/nazionali/internazionali. |
| Numeri di identificazione delle Nazioni Unite | ONU1500 |
| Codice SA | 283410 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico per ingestione, inalazione e assorbimento cutaneo. Può causare metaemoglobinemia. Irritante per gli occhi, la pelle e il sistema respiratorio. |
Metodi per la sintesi del nitrito di sodio
Esistono diversi metodi per sintetizzare NaNo2.
Un metodo comune è quello di far reagire acido nitrico e idrossido di sodio , che produce nitrato di sodio. Un agente riducente come ferro o zinco riduce il nitrato di sodio, formando NaNo2.
Un altro metodo prevede la reazione del nitrato di sodio con acido cloridrico , producendo una miscela di acido nitrico e cloruro di sodio. L’idrossido di sodio reagisce con l’acido nitrico per produrre NaNo2.
La sintesi di NaNo2 può avvenire attraverso la reazione tra ammoniaca e nitrato di sodio , che produce NaNo2 e acqua come prodotti.
Il processo di produzione dell’acido nitrico produce NaNo2 come sottoprodotto ossidando l’ammoniaca nel processo.
Usi del nitrito di sodio
NaNo2 ha vari usi in vari settori, alcuni dei quali includono:
- Conservazione degli alimenti: comunemente usato come conservante alimentare, soprattutto nei salumi come pancetta e hot dog. Aiuta a prevenire la crescita di batteri nocivi e preserva il colore e il sapore della carne.
- Applicazioni industriali: utilizzato in varie applicazioni industriali, come la lavorazione dei metalli e come inibitore della corrosione. Utilizzato anche nella produzione di coloranti e altri prodotti chimici.
- Applicazioni mediche: usato in medicina per trattare l’avvelenamento da cianuro perché converte l’emoglobina in metaemoglobina, che può legarsi agli ioni di cianuro e impedire loro di legarsi all’emoglobina.
- Trattamento dell’acqua: utilizzato nel trattamento dell’acqua per controllare la crescita di batteri e alghe nocivi nei sistemi idrici.
- Agricoltura: utilizzato in agricoltura come fertilizzante, contribuendo a migliorare la resa e la qualità dei raccolti.
- Fotografia: utilizzato in fotografia come agente di sviluppo.
Domande:
D: Cos’è il nitrito di sodio?
R: NaNo2 è un composto chimico con la formula NaNO2. È una polvere cristallina bianca o leggermente giallastra comunemente usata come conservante alimentare e in varie applicazioni industriali.
D: Chi ha scoperto il nitrito di sodio?
R: NaNO2 fu scoperto per la prima volta nel 1805 dal chimico francese Louis Nicolas Vauquelin.
D: Il nitrito di sodio fa male?
R: Un consumo eccessivo di NaNo2 può essere dannoso per la salute umana. È stato collegato a problemi di salute come il cancro e la metaemoglobinemia, una malattia in cui il sangue non è in grado di trasportare efficacemente l’ossigeno. Tuttavia, se utilizzato in quantità regolamentate e limitate, NaNo2 è considerato sicuro per il consumo.
D: Qual è la formula del nitrito di sodio?
R: La formula del nitrito di sodio è NaNO2.
D: Il nitrito di sodio è sicuro?
R: NaNo2 è generalmente considerato sicuro per il consumo se utilizzato in quantità regolamentate e limitate. Tuttavia, un consumo eccessivo può essere dannoso per la salute umana.
D: Come produrre il nitrito di sodio?
R: NaNo2 può essere sintetizzato con vari metodi, come la reazione dell’acido nitrico e dell’idrossido di sodio, la reazione del nitrato di sodio con acido cloridrico e la reazione dell’ammoniaca con il nitrato di sodio. Tuttavia, la sintesi di NaNo2 deve essere effettuata con cautela, poiché comporta l’uso di sostanze chimiche pericolose e richiede l’adozione di adeguate misure di sicurezza.
D: Il nitrito di sodio è un ossidante?
R: Sì, NaNo2 è un ossidante. È comunemente usato in pirotecnica come agente ossidante.
D: In che modo il nitrito di sodio influisce sul colore della carne?
R: NaNO2 è comunemente usato come conservante alimentare nei salumi come pancetta e hot dog. Aiuta a preservare il colore della carne inibendo la crescita di batteri nocivi che possono causare scolorimento.
D: Come vengono prodotti commercialmente NaNO2 e NaNO3?
R: NaNO3 e NaNO2 vengono prodotti commercialmente mediante vari metodi, come l’ossidazione dell’ammoniaca e la reazione dell’idrossido di sodio con l’acido nitrico. Sono utilizzati in varie applicazioni industriali, mediche e agricole, nonché nella conservazione degli alimenti.
