Il nitrato di potassio (KNO3) è un sale cristallino bianco spesso utilizzato nei fertilizzanti, nella conservazione degli alimenti e nei fuochi d’artificio. È anche un ingrediente chiave in alcuni dentifrici per denti sensibili.
| Nome IUPAC | Nitrato di potassio |
| Formula molecolare | KNO3 |
| numero CAS | 7757-79-1 |
| Sinonimi | salnitro; nitrato di potassio; nitro; salnitro; E252; salnitro cinese; acido nitrico, sale di potassio; Nitras di Kalii |
| InChI | InChI=1S/K.NO3/c;2-1(3)4/q+1;-1 |
Proprietà del nitrato di potassio
Formula di nitrato di potassio
La formula chimica del nitrato di potassio è KNO3. Questa formula mostra che il composto è costituito da uno ione potassio, uno ione nitrato e tre ioni ossigeno. La formula è utile per calcolare la quantità di nitrato di potassio necessaria in una reazione, nonché per identificare gli elementi e gli ioni presenti nel composto.
Massa molare del nitrato di potassio
KNO3 ha una massa molare di 101,1 g/mol. La massa molare è la massa di una mole di una sostanza e si calcola sommando le masse atomiche di tutti gli atomi del composto. Nel caso di KNO3, la massa molare viene calcolata sommando la massa atomica di un atomo di potassio, un atomo di azoto e tre atomi di ossigeno. Questo valore è utile per determinare la quantità di KNO3 necessaria in una reazione e per calcolare altre proprietà come la concentrazione.
Punto di ebollizione del nitrato di potassio
KNO3 ha un punto di ebollizione relativamente alto di 1.336 °C (2.437 °F). Ciò significa che è necessaria molta energia per rompere i legami tra gli atomi del composto e trasformarlo da liquido a gassoso. Questa proprietà rende KNO3 utile in applicazioni che richiedono reazioni ad alta temperatura, come nella produzione di fuochi d’artificio.
Punto di fusione del nitrato di potassio
KNO3 ha un punto di fusione di 334°C (633°F). Ciò significa che a temperature superiori a 334°C, KNO3 cambierà da solido a liquido. Questa proprietà rende KNO3 utile in applicazioni come la produzione del vetro, dove viene utilizzato come flusso per abbassare il punto di fusione della silice.
Densità del nitrato di potassio g/mL
La densità di KNO3 è 2,109 g/mL a temperatura ambiente. La densità è una misura della massa per unità di volume di una sostanza. La densità di KNO3 è importante in applicazioni come la produzione di fertilizzanti, dove viene utilizzato come fonte di azoto e potassio. La densità è utile anche per determinare la quantità di KNO3 necessaria in un dato volume di soluzione.
Peso molecolare del nitrato di potassio
Il peso molecolare di KNO3 è 101,1 g/mol. Questo valore viene calcolato sommando i pesi atomici di tutti gli atomi presenti nel composto. Il peso molecolare è utile per calcolare altre proprietà di KNO3, come la quantità di KNO3 necessaria in una reazione o la concentrazione di una soluzione.
Struttura del nitrato di potassio
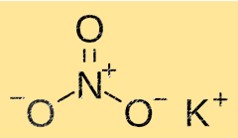
KNO3 ha una struttura cristallina composta da ioni potassio, nitrato e ossigeno. Gli ioni potassio sono circondati da sei ioni nitrato, mentre gli ioni nitrato sono circondati da sei ioni potassio. Questa struttura conferisce a KNO3 le sue proprietà caratteristiche come solubilità, punto di fusione e densità.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 2.109 g/cm³ a 20°C |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 101,1032 g/mole |
| Densità | 2.109 g/cm³ |
| Punto di fusione | 334°C (633°F) |
| Punto di ebollizione | 400°C (752°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | 133 g/l a 20°C |
| Solubilità | Solubile in glicerolo, ammoniaca e acqua |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | 4,75 |
| pH | 6.9 – 7.3 |
Sicurezza e pericoli del nitrato di potassio
KNO3 è relativamente sicuro se maneggiato correttamente, ma può presentare pericoli se maneggiato in modo improprio. È classificato come ossidante, il che significa che può favorire la combustione di altri materiali. KNO3 può anche irritare gli occhi, la pelle e le vie respiratorie e può essere tossico se ingerito o inalato in grandi quantità. È importante indossare dispositivi di protezione come guanti, occhiali e un respiratore quando si maneggia KNO3 e conservarlo in un luogo fresco e asciutto, lontano da materiali infiammabili. Dovrebbero essere seguiti anche metodi di smaltimento adeguati per evitare la contaminazione dell’ambiente.
| Simboli di pericolo | O, Xn |
| Descrizione della sicurezza | Tenere lontano da fonti di calore/scintille/fiamme libere/superfici calde. Indossare guanti protettivi/proteggere gli occhi/il viso. IN CASO DI INGESTIONE: chiamare un CENTRO ANTIVELENI/un medico se non ci si sente bene. Sciacquati la bocca. Non provoca il vomito. IN CASO DI INALAZIONE: trasportare la vittima all’aria aperta e mantenerla a riposo in una posizione che favorisca la respirazione. Chiamare un CENTRO ANTIVELENI/un medico. |
| Numeri di identificazione delle Nazioni Unite | 1486 |
| Codice SA | 2834.21.00 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | III |
| Tossicità | Può causare irritazione respiratoria, tosse e mancanza di respiro se inalato. Può causare irritazione agli occhi e alla pelle. L’ingestione può causare dolore addominale, nausea, vomito e diarrea. Può essere tossico se ingerito o inalato in grandi quantità. |
Metodi di sintesi del nitrato di potassio
Diversi metodi possono sintetizzare KNO3.
Un metodo comune è la reazione tra idrossido di potassio e acido nitrico . Il recipiente di reazione mescola le due sostanze e le riscalda ad alta temperatura, solitamente intorno agli 80°C. Successivamente la miscela si raffredda e il processo di filtrazione recupera il solido KNO3.
Un altro metodo è la reazione tra cloruro di potassio e nitrato di sodio. Una persona mescola le due sostanze in un recipiente di reazione e le riscalda ad alta temperatura, solitamente intorno ai 600°C.
La miscela risultante si scioglie e poi si solidifica, formando cristalli KNO3.
Un terzo metodo prevede l’ossidazione dell’ammoniaca mediante acido nitrico in presenza di un catalizzatore. Questo metodo è più complesso e generalmente utilizzato su scala industriale.
KNO3 può essere estratto da fonti naturali, come grotte e depositi sotterranei. Tuttavia, questo metodo è meno comune a causa delle basse rese e delle impurità presenti nel KNO3 estratto.
Usi del nitrato di potassio
KNO3 ha una vasta gamma di usi in vari settori grazie alle sue proprietà chimiche. Ecco alcuni usi comuni di KNO3:
- Fertilizzante – Utilizzato come fertilizzante grazie al suo alto contenuto di azoto e potassio. È particolarmente utile per le colture che richiedono elevati livelli di potassio, come frutta, verdura e tabacco.
- Conservazione degli alimenti – Utilizzato anche come conservante alimentare, soprattutto nei salumi. Inibisce la crescita dei batteri e previene il deterioramento, prolungando così la durata di conservazione del prodotto.
- Pirotecnica – È un elemento chiave nella fabbricazione di fuochi d’artificio e altri dispositivi pirotecnici. Agisce come ossidante, producendo ossigeno per alimentare la combustione di altri materiali.
- Dentifricio – Aggiunto ad alcuni dentifrici per ridurre la sensibilità dei denti. Funziona bloccando la trasmissione dei segnali di dolore dal nervo dentale al cervello.
- Usi medicinali – Usato in medicina per le sue proprietà diuretiche ed espettoranti. Tratta anche l’angina e l’ipertensione.
- Applicazioni industriali – Utilizzato anche in varie applicazioni industriali, come la produzione di vetro, ceramica e coloranti.
Domande:
D: Il nitrato di potassio è solubile in acqua?
R: Sì, KNO3 è altamente solubile in acqua. A temperatura ambiente, 100 grammi di acqua possono sciogliere circa 37 grammi di KNO3.
D: A cosa serve il nitrato di potassio?
R: KNO3 viene utilizzato per una varietà di scopi, tra cui come fertilizzante, conservante alimentare, ossidante pirotecnico, ingrediente per dentifricio e come componente nella produzione di vetro, ceramica e coloranti.
D: Cos’è il nitrato di potassio?
R: Il nitrato di potassio, noto anche come salnitro, è un composto chimico con la formula KNO3. È un sale ionico composto da ioni potassio (K+) e ioni nitrato (NO3-).
D: Cosa neutralizza il nitrato di potassio?
R: Gli ioni di calcio e magnesio possono contrastare gli effetti dannosi di un eccesso di KNO3 nelle piante. Negli esseri umani non esiste un antidoto noto per l’avvelenamento da KNO3 e il trattamento è molto utile.
D: Kno3 è solubile in acqua?
R: Sì, KNO3 è altamente solubile in acqua.
D: Cos’è un prodotto dell’elettrolisi dell’acqua contenente una bassa concentrazione di kno3?
R: I prodotti dell’elettrolisi dell’acqua contenenti una bassa concentrazione di KNO3 sono gas idrogeno (H2) e gas ossigeno (O2).
D: Cos’è kno3?
R: KNO3 è la formula chimica del nitrato di potassio, noto anche come salnitro.
D: Qual è lo stato di ossidazione di un singolo atomo di azoto in kno3?
R: In KNO3, lo stato di ossidazione di ciascun atomo di azoto è +5.
D: Kno3 è un acido o una base?
R: KNO3 non è né un acido né una base. È un sale, composto da un catione (K+) e un anione (NO3-).
