Il nitrato di litio (LiNO₃) è un composto chimico utilizzato in varie applicazioni. Presenta proprietà uniche, come la sua solubilità in acqua e il suo ruolo nella produzione di ceramica e vetro.
| Nome IUPAC | Nitrato di litio |
| Formula molecolare | LiNO₃ |
| numero CAS | 7790-69-4 |
| Sinonimi | Nitrato di litio, sale di litio dell’acido nitrico, nitrato di litio (I). |
| InChi | InChI=1S/Li.NO3/c;2-1(3)4/q+1;-1 |
Proprietà del nitrato di litio
Formula di nitrato di litio
La formula del sale di litio dell’acido nitrico è LiNO₃. È costituito da un atomo di litio (Li), un atomo di azoto (N) e tre atomi di ossigeno (O). Questa formula chimica rappresenta la composizione di ciascun elemento nel composto.
Massa molare del nitrato di litio
Il sale di litio dell’acido nitrico ha una massa molare di circa 68,95 g/mol. La massa molare si riferisce alla massa di una mole di una sostanza e si calcola sommando le masse atomiche di tutti gli atomi nella formula.
Punto di ebollizione del nitrato di litio
Il sale di litio dell’acido nitrico ha un punto di ebollizione di circa 600°C (1112°F). Il punto di ebollizione è la temperatura alla quale una sostanza cambia da liquido a gas sotto la pressione atmosferica standard.
Punto di fusione del nitrato di litio
Il sale di litio dell’acido nitrico ha un punto di fusione di circa 255°C (491°F). Il punto di fusione è la temperatura alla quale una sostanza passa da solida a liquida sotto pressione atmosferica standard.
Densità del nitrato di litio g/mL
La densità del sale di litio dell’acido nitrico è di circa 2,38 g/mL. La densità rappresenta la massa di una sostanza per unità di volume ed è una proprietà importante per comprenderne il comportamento fisico.
Peso molecolare del nitrato di litio
Il peso molecolare del sale di litio dell’acido nitrico è 68,95 g/mol. Il peso molecolare è la somma dei pesi atomici di tutti gli atomi di una molecola ed è espresso in grammi per mole.
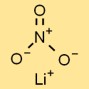
Struttura del nitrato di litio
Il sale di litio dell’acido nitrico ha una struttura cristallina ionica, dove i cationi litio (Li⁺) e gli anioni nitrato (NO₃⁻) formano uno schema ripetuto regolare. Questa struttura contribuisce alla sua stabilità e alle sue proprietà caratteristiche.
Solubilità del nitrato di litio
Il sale di litio dell’acido nitrico è altamente solubile in acqua. Questa elevata solubilità è una delle sue caratteristiche essenziali e lo rende utile in varie applicazioni, come nella produzione di ceramica e vetro.
| Aspetto | Solido bianco |
| Peso specifico | N / A |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 68,95 g/mole |
| Densità | 2,38 g/ml |
| Punto di fusione | 255°C (491°F) |
| Punto di ebollizione | 600°C (1112°F) |
| Punto flash | N / A |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in acqua e solventi organici come l’etanolo |
| Pressione del vapore | N / A |
| Densità del vapore | N / A |
| pKa | N / A |
| pH | N / A |
Tieni presente che alcune proprietà potrebbero non essere applicabili (N/A) o avere dati limitati disponibili per il nitrato di litio.
Sicurezza e pericoli del nitrato di litio
Il sale di litio dell’acido nitrico pone alcune considerazioni sulla sicurezza e sui rischi. Può essere irritante per la pelle, gli occhi e le vie respiratorie per contatto o inalazione. Durante la manipolazione è fondamentale utilizzare adeguati dispositivi di protezione come guanti e occhiali di sicurezza. Evitare l’ingestione poiché ciò potrebbe causare disturbi gastrointestinali. Conservarlo lontano da sostanze incompatibili per evitare reazioni pericolose. In caso di fuoriuscite o perdite, contenerle e pulirle tempestivamente. Inoltre, seguire sempre le linee guida per la conservazione corretta e conservarlo in un’area sicura e ben ventilata. Dare priorità alle pratiche di manipolazione sicura e seguire i protocolli di sicurezza pertinenti per ridurre al minimo i rischi associati al sale di litio dell’acido nitrico.
| Simboli di pericolo | Avvertimento |
| Descrizione della sicurezza | – Irritante per la pelle, gli occhi e le vie respiratorie. – Evitare l’ingestione. – Utilizzare dispositivi di protezione. – Conservare in un luogo ben ventilato. |
| Numeri di identificazione delle Nazioni Unite | UN1477 |
| Codice SA | 28342990 |
| Classe di pericolo | 5.1 (Agente ossidante) |
| Gruppo di imballaggio | II |
| Tossicità | Bassa tossicità, ma deve essere maneggiato con cura e misure di sicurezza adeguate. |
Si prega di notare che i simboli di pericolo specifici e le raccomandazioni di sicurezza possono variare a seconda della giurisdizione e delle normative. Fare sempre riferimento alle schede tecniche di sicurezza appropriate e alle linee guida di sicurezza locali quando si maneggia il sale di litio dell’acido nitrico.
Metodi di sintesi del nitrato di litio
Esistono diversi metodi per sintetizzare il sale di litio dell’acido nitrico.
Un approccio comune prevede la reazione tra carbonato di litio (Li₂CO₃) e acido nitrico (HNO₃) . Durante questo processo, i due composti reagiscono per produrre sale di litio dell’acido nitrico e acqua (H₂O) come sottoprodotti. L’equazione chimica per questa reazione è:
Li₂CO₃ + 2HNO₃ → 2LiNO₃ + H₂O
Un altro metodo consiste nel far reagire l’idrossido di litio (LiOH) con l’acido nitrico per ottenere il sale di litio dell’acido nitrico e dell’acqua. L’equazione di reazione è:
LiOH + HNO₃ → LiNO₃ + H₂O
Il sale di litio dell’acido nitrico si forma neutralizzando l’acido nitrico con ossido di litio (Li₂O) o carbonato di litio. Le equazioni sono:
Li₂O + 2HNO₃ → 2LiNO₃ + H₂O Li₂CO₃ + 2HNO₃ → 2LiNO₃ + CO₂ + H₂O
In tutti questi metodi, è importante maneggiare i reagenti e i prodotti con cautela a causa della loro reattività e dei potenziali pericoli. Misure di sicurezza adeguate e condizioni controllate sono essenziali durante il processo di sintesi per garantire la produzione di successo del sale di litio dell’acido nitrico.
Usi del nitrato di litio
Il sale di litio dell’acido nitrico trova varie applicazioni grazie alle sue proprietà uniche. Ecco i suoi usi:
- Trattamento dell’aria: il sale di litio dell’acido nitrico agisce come essiccante nelle applicazioni di trattamento dell’aria, rimuovendo l’umidità dall’aria per prevenire la corrosione e mantenere condizioni ambientali ottimali.
- Reagenti nella sintesi chimica: serve come fonte di ioni nitrato in varie reazioni chimiche, rendendolo utile nella sintesi di altri composti e sostanze.
- Prodotti chimici speciali: trovano applicazione nella produzione di prodotti chimici speciali, inclusi catalizzatori e inibitori della corrosione.
- Articoli pirotecnici e fuochi d’artificio: il sale di litio dell’acido nitrico svolge un ruolo cruciale come ossidante negli articoli pirotecnici, contribuendo al colore rosso brillante visto nei fuochi d’artificio.
- Industria farmaceutica: l’industria farmaceutica utilizza il sale di litio dell’acido nitrico come reagente nella sintesi chimica e nella ricerca per determinate formulazioni farmaceutiche.
- Batterie al litio: sebbene non venga utilizzato direttamente nelle batterie, il sale di litio dell’acido nitrico è rilevante per l’industria delle batterie agli ioni di litio. I produttori incorporano sali di litio derivati dal sale di litio dell’acido nitrico negli elettroliti utilizzati in queste batterie.
- Reattori nucleari: alcuni tipi di reattori nucleari utilizzano il sale di litio dell’acido nitrico come refrigerante a causa delle sue proprietà di assorbimento dei neutroni.
- Produzione di ceramica e vetro: nei processi di produzione di ceramica e vetro, il sale di litio dell’acido nitrico funge da agente fondente. Abbassa efficacemente il punto di fusione dei materiali, migliorandone così la lavorabilità e la qualità del prodotto.
- Fluidi termovettori: il sale di litio dell’acido nitrico trova applicazione nei fluidi termovettori, in particolare nei sistemi ad energia solare, grazie alla sua elevata solubilità in acqua. Facilita un efficiente scambio termico e consente l’accumulo di energia termica.
Domande:
D: Quanti atomi totali ci sono in una molecola di nitrato di litio, LiNO₃?
R: Ci sono 5 atomi in una molecola di sale di litio dell’acido nitrico: 1 atomo di litio (Li), 1 atomo di azoto (N) e 3 atomi di ossigeno (O).
D: Quali sono le formule corrette per il nitrato di rame (II) esaidrato e il cromato di litio diidrato?
R: Le formule corrette sono Cu(NO₃)₂·6H₂O per il nitrato di rame(II) esaidrato e Li₂CrO₄·2H₂O per il cromato di litio diidrato.
D: Quanti grammi di nitrato di litio saranno necessari per preparare 250 ml di una soluzione 0,5 M?
R: Avrai bisogno di 17,24 grammi di sale di litio dell’acido nitrico per preparare 250 ml di una soluzione 0,5 M.
D: Il nitrato di litio è ionico o covalente?
R: Il sale di litio dell’acido nitrico è un composto ionico.
D: LiNO₃ è solubile in acqua?
R: Sì, il nitrato di litio (LiNO₃) è solubile in acqua.
D: Quale coefficiente dovrebbe apparire prima di LiNO₃ nell’equazione bilanciata?
R: Il coefficiente “2” deve apparire prima di LiNO₃ nell’equazione bilanciata.
D: Quanti dei seguenti composti sono solubili in acqua? Pb(OH)₂, LiNO₃, NH₄Br, K₂S
R: Tre dei composti sono solubili in acqua: LiNO₃, NH₄Br e K₂S.
D: Il LiNO₃ è solubile?
R: Sì, LiNO₃ è solubile.
D: LiNO₃ è acquoso o solido?
R: LiNO₃ è acquoso quando disciolto in acqua.
D: LiNO₃ è acido, basico o neutro?
R: Il sale di litio dell’acido nitrico (LiNO₃) è un composto neutro.
D: Quanti atomi totali ci sono in una molecola di nitrato di litio, LiNO₃?
R: Ci sono 5 atomi in una molecola di nitrato di litio: 1 atomo di litio (Li), 1 atomo di azoto (N) e 3 atomi di ossigeno (O).
D: LiNO₃ è ionico o covalente?
R: LiNO₃ è un composto ionico.
