Il nitrato di calcio è un composto chimico con la formula Ca(NO3)2. È un solido incolore e inodore che è molto solubile in acqua. Il nitrato di calcio è comunemente usato come fertilizzante e nel trattamento delle acque reflue. Viene utilizzato anche nella produzione del calcestruzzo, come componente di esplosivi e nella fabbricazione di vari altri prodotti chimici.
| Nome IUPAC | Dinitrato di calcio |
| Formula molecolare | Ca(NO3)2 |
| numero CAS | 10124-37-5 |
| Sinonimi | Nitrato di calcio tetraidrato, sale di calcio dell’acido nitrico, nitrocalcite, salnitro norvegese, salnitro calcareo, Norgessalpeter |
| InChI | InChI=1S/Ca.2NO3/c;22-1(3)4/q+2;2-1 |
Formula del nitrato di calcio
La formula del nitrato di calcio è Ca(NO3)2. Ciò significa che ciascuna unità di nitrato di calcio contiene uno ione calcio (Ca²⁺) e due ioni nitrato (NO3⁻). La formula del nitrato di calcio viene spesso utilizzata per determinare la massa molare e altre proprietà del composto.
Massa molare del nitrato di calcio
Il nitrato di calcio ha una massa molare di 164.088 g/mol. È un sale composto da ioni Ca+2 e NO3-, con la formula Ca(NO3)2. La massa molare di un composto è la massa in grammi di una mole di quel composto di formula, che è uguale al suo peso. Nel caso di Ca(NO3)2, il peso della formula è la somma dei pesi atomici di tutti gli atomi del composto.
Punto di ebollizione del nitrato di calcio
Ca(NO3)2 ha un punto di ebollizione relativamente alto di 132 gradi Celsius. Ciò significa che è necessaria una quantità significativa di energia per convertire il composto solido in un gas. L’alto punto di ebollizione del Ca(NO3)2 è dovuto alla sua natura ionica, che risulta in forti interazioni elettrostatiche tra gli ioni Ca+2 e NO3-.
Punto di fusione del nitrato di calcio
Il punto di fusione di Ca(NO3)2 è 561 gradi Celsius. Questo è relativamente elevato per un sale e riflette ancora una volta le forti interazioni ioniche tra gli ioni Ca+2 e NO3-. Il punto di fusione di Ca(NO3)2 lo rende un composto utile per applicazioni ad alta temperatura, come nella produzione di fertilizzanti o esplosivi.
Densità del nitrato di calcio g/ml
La densità di Ca(NO3)2 varia a seconda della sua forma. Ad esempio, la densità del Ca(NO3)2 anidro è di circa 2,5 g/cm³, mentre la densità del tetraidrato (Ca(NO3)2,4H2O) è di circa 1,82 g/cm³. Questi valori rendono Ca(NO3)2 un composto relativamente denso rispetto a molti altri sali.
Peso molecolare del nitrato di calcio
Il peso molecolare di Ca(NO3)2 è 164,088 g/mol. Questo valore è la somma dei pesi atomici di tutti gli atomi del composto, che comprende due atomi di azoto, sei atomi di ossigeno e un atomo di calcio.
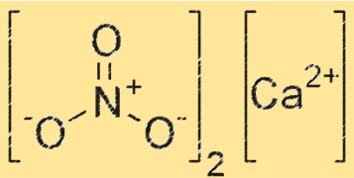
Struttura del nitrato di calcio
Ca(NO3)2 ha una struttura ionica, con lo ione calcio (Ca²⁺) circondato da sei atomi di ossigeno in una disposizione ottaedrica. Lo ione NO3- è presente anche nel reticolo cristallino, con ciascun atomo di ossigeno dello ione NO3- che forma un legame di coordinazione con lo ione Ca+2. La struttura del Ca(NO3)2 è simile a quella di altri composti ionici, come il cloruro di sodio.
| Aspetto | Cristalli bianchi o polvere |
| Peso specifico | 2,5 (anidro); 1,82 (tetraidrato) |
| Colore | Incolore (anidro); Bianco (tetraidrato) |
| Odore | Inodore |
| Massa molare | 164.088 g/mole |
| Densità | 2,5 g/cm³ (anidro); 1,82 g/cm³ (tetraidrato) |
| Punto di fusione | 561°C (anidro); 45°C (tetraidrato) |
| Punto di ebollizione | 132°C (si decompone) |
| Punto flash | Non applicabile |
| solubilità in acqua | 121,2 g/100 ml (0°C); 126,7 g/100 ml (20°C); 179,6 g/100 ml (100 °C) |
| Solubilità | Solubile in acqua, etanolo, metanolo |
| Pressione del vapore | Trascurabile (anidro) |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | 4,5-7,5 (soluzione al 10%) |
Sicurezza e pericoli del nitrato di calcio
Il nitrato di calcio (Ca(NO3)2) può comportare numerosi pericoli se non maneggiato correttamente. È un forte agente ossidante che può provocare incendi o esplosioni se entra in contatto con materiali combustibili. Il composto può anche causare irritazione alla pelle e agli occhi al contatto e l’inalazione di polvere può causare irritazione del tratto respiratorio. Il Ca(NO3)2 deve essere conservato in un luogo fresco e asciutto, lontano da fonti di calore e non deve essere miscelato con altri prodotti chimici senza le dovute precauzioni. Quando si maneggia Ca(NO3)2 è necessario indossare dispositivi di protezione individuale come guanti e protezione per gli occhi per evitare il contatto con la pelle o gli occhi. In caso di ingestione accidentale, consultare immediatamente un medico.
| Simboli di pericolo | Agente ossidante (GHS05), Irritante (GHS07) |
| Descrizione della sicurezza | S22: Non respirare polvere/fumi/gas/nebbia/vapori/aerosol. S26: In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico. S36/37/39: Indossare indumenti protettivi, guanti e proteggersi gli occhi/il viso adeguati. |
| Identificatori AN | UN1454 (nitrato di calcio anidro), UN1455 (nitrato di calcio tetraidrato) |
| Codice SA | 283429 |
| Classe di pericolo | 5.1 (Agenti ossidanti) |
| Gruppo di imballaggio | III |
| Tossicità | Orale (LD50): 3.420 mg/kg (ratto); Cutanea (LD50): > 5.000 mg/kg (coniglio); Inalazione (LC50): >4,8 mg/l/4h (ratto) |
Metodi di sintesi del nitrato di calcio
Esistono vari metodi per sintetizzare Ca(NO3)2 a seconda dell’applicazione specifica e della purezza desiderata.
Un metodo comune consiste nel far reagire il carbonato di calcio con l’acido nitrico per produrre Ca(NO3)2 e anidride carbonica:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
Un altro metodo consiste nel far reagire l’idrossido di calcio con l’acido nitrico :
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
La reazione tra acido nitrico e ossido di calcio dà Ca(NO3)2:
CaO + 2HNO3 → Ca(NO3)2 + H2O
Il Ca(NO3)2 risultante può essere ulteriormente purificato mediante ricristallizzazione o aggiungendo una piccola quantità di acido solforico per rimuovere impurità come ferro e alluminio.
I produttori possono produrre Ca(NO3)2 facendo reagire il calcio metallico con l’acido nitrico o facendo reagire l’idrossido di calcio con il nitrato di ammonio. Tuttavia, questi metodi vengono utilizzati meno comunemente a causa dei costi più elevati o dei problemi di sicurezza associati ai metalli reattivi o al nitrato di ammonio.
Usi del nitrato di calcio
- Utilizzato come fertilizzante in agricoltura per fornire alle piante nutrienti di calcio e azoto per la crescita.
- Utilizzato come componente in diversi tipi di calcestruzzo e cemento per migliorarne la resistenza e la durabilità.
- Utilizzato come additivo nella produzione di prodotti chimici per il trattamento delle acque reflue per aiutare a rimuovere i composti di fosforo e azoto dall’acqua.
- Utilizzato nella produzione di diversi tipi di esplosivi e fuochi d’artificio grazie alle sue proprietà ossidanti.
- Utilizzato come fonte di calcio e azoto nella produzione di vari prodotti chimici come nylon e altre fibre sintetiche.
- Utilizzato come inibitore della corrosione per metalli come alluminio e acciaio in applicazioni industriali.
- Utilizzato nella conservazione della carne e come additivo alimentare per migliorare la qualità di alcuni prodotti alimentari.
- Utilizzato nella produzione di fumogeni e razzi per applicazioni militari e civili.
- Utilizzato nella produzione di alcuni fertilizzanti. Utilizzato anche in combinazione con altri composti per fornire un apporto equilibrato di nutrienti alle colture.
- Utilizzato come componente in alcuni fertilizzanti speciali per acquari per fornire nutrienti essenziali alle piante acquatiche.
Domande:
D: Qual è il nome di Ca(NO3)2?
R: Il nome di Ca(NO3)2 è nitrato di calcio.
D: Il Ca(NO3)2 è solubile in acqua?
R: Sì, Ca(NO3)2 è altamente solubile in acqua. A temperatura ambiente, 100 grammi di acqua possono sciogliere fino a 121 grammi di nitrato di calcio.
D: Dove acquistare il nitrato di calcio?
R: Il Ca(NO3)2 può essere acquistato da vari fornitori di prodotti chimici, online e nei negozi. Alcuni luoghi comuni in cui acquistare Ca(NO3)2 includono aziende di forniture scientifiche, negozi di forniture agricole e centri per la casa e il giardinaggio. È importante garantire che il fornitore sia affidabile e che il prodotto sia di alta qualità e adatto all’applicazione prevista.
