Il nitrato di bario (Ba(NO3)2) è un solido bianco. Si dissolve in acqua e forma ioni bario e nitrato. Potrebbe esplodere se riscaldato o miscelato con combustibili.
| Nome dell’IUPAC | Dinitrato di bario |
| Formula molecolare | Ba(NO3)2 |
| numero CAS | 10022-31-8 |
| Sinonimi | Nitrato di bario, bariodinitrato, dinitrato di bario, CQ9625000, (nitroossi)nitrato di bario |
| InChI | InChI=1S/Ba.2NO3/c;2 2-1(3)4/q+2;2 -1 |
Proprietà del nitrato di bario
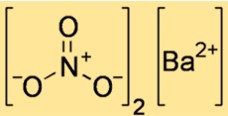
Formula di nitrato di bario
La formula molecolare del nitrato di bario è Ba(NO3)2. Mostra che una molecola di nitrato di bario è costituita da un atomo di bario e due molecole di nitrato. Lo ione nitrato ha una carica pari a -1 e lo ione bario ha una carica pari a +2, quindi si combinano in un rapporto 1:2 per formare un composto neutro.
Massa molare del nitrato di bario
La massa molare di Ba(NO3)2 è 261,337 g/mol. È la massa di una mole di molecole di Ba(NO3)2. Per calcolarlo, devi aggiungere le masse atomiche di tutti gli atomi nella formula:
Massa molare di Ba(NO3)2 = (1 x 137,327) + (2 x 14,007) + (6 x 15,999) = 261,337 g/mol
Punto di ebollizione del nitrato di bario
Il punto di ebollizione di Ba(NO3)2 è 83°C. Questa è la temperatura alla quale Ba(NO3)2 passa dallo stato liquido allo stato gassoso. Tuttavia, il Ba(NO3)2 si decompone prima di raggiungere il punto di ebollizione, quindi non è possibile farlo bollire senza scomporlo in altre sostanze.
Nitrato di bario Punto di fusione
Il punto di fusione di Ba(NO3)2 è 592°C. Questa è la temperatura alla quale Ba(NO3)2 passa da solido a liquido. Ba(NO3)2 è un solido cristallino bianco a temperatura e pressione ambiente, ma si scioglie se riscaldato al di sopra del suo punto di fusione.
Densità del nitrato di bario g/ml
La densità di Ba(NO3)2 è 3,23 g/ml. Questa è la massa per unità di volume di Ba(NO3)2. Per calcolarlo, devi dividere la massa di un campione di Ba(NO3)2 per il suo volume:
Densità di Ba(NO3)2 = Massa/Volume
Ad esempio, se abbiamo un campione di 10 g di Ba(NO3)2 e il suo volume è 3,1 ml, la sua densità sarà:
Densità di Ba(NO3)2 = 10 / 3,1 = 3,23 g/ml
Peso molecolare del nitrato di bario
Il peso molecolare di Ba(NO3)2 è uguale alla sua massa molare, che è 261,337 g/mol. È la massa di una mole di molecole di Ba(NO3)2. A volte il termine peso molecolare è usato in modo intercambiabile con massa molare, ma non sono esattamente la stessa cosa. Il peso molecolare si riferisce alla massa media di una molecola di una sostanza, mentre la massa molare si riferisce alla massa di una mole di una sostanza.
Struttura del nitrato di bario
La struttura di Ba(NO3)2 mostra come sono disposti gli atomi e gli ioni nello spazio. Ba(NO3)2 è un composto ionico, il che significa che è costituito da ioni bario caricati positivamente e ioni nitrato caricati negativamente tenuti insieme da forze elettrostatiche. La struttura di Ba(NO3)2 può essere rappresentata da una cella unitaria, che è la più piccola unità ripetitiva che mostra la disposizione degli ioni in un reticolo cristallino.
Una cella unitaria di Ba(NO3)2 ha una forma cubica, con uno ione bario su ciascun angolo e uno ione nitrato al centro di ciascuna faccia. Il numero di coordinazione di ciascuno ione è sei, il che significa che ogni ione è circondato da sei ioni con carica opposta. La lunghezza di ciascun bordo della cella unitaria è 0,65 nm.
Solubilità del nitrato di bario
La solubilità di Ba(NO3)2 è la quantità di Ba(NO3)2 che può dissolversi in una determinata quantità di solvente, solitamente acqua. La solubilità dipende da diversi fattori, come la temperatura, la pressione e la presenza di altre sostanze nella soluzione.
A 20°C e pressione atmosferica, la solubilità di Ba(NO3)2 in acqua è di circa 34 g per 100 ml. Ciò significa che in queste condizioni 34 g di Ba(NO3)2 possono dissolversi in 100 ml di acqua. La solubilità aumenta con l’aumentare della temperatura e diminuisce con l’aumentare della pressione.
Ba(NO3)2 è solubile anche in altri solventi, come etanolo, acetone e metanolo, ma meno solubile che in acqua.
| Aspetto | Solido bianco |
| Densità specifica | 3.23 |
| Colore | Incolore, argento o grigio |
| Odore | Inodore |
| Massa molare | 261.337 g/mole |
| Densità | 3,23 g/ml |
| Punto di fusione | 592°C |
| Punto di ebollizione | 83°C |
| Punto flash | Non infiammabile |
| solubilità in acqua | 34 g per 100 ml a 20°C |
| Solubilità | Solubile in etanolo, acetone e metanolo; insolubile in etere e cloroformio |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Non disponibile |
Sicurezza e pericoli del nitrato di bario
Ba(NO3)2 è una sostanza tossica e ossidante. Può farti male se lo ingoi o lo respiri. Ciò può irritare gli occhi, la pelle e il sistema respiratorio. Il Ba(NO3)2 può anche causare spasmi muscolari, problemi cardiaci e morte. Si dovrebbe evitare il contatto con Ba(NO3)2 e indossare dispositivi di protezione durante la manipolazione. Dovresti anche tenerlo lontano da fonti di calore, scintille, fiamme e materiali combustibili. Se sei esposto a Ba(NO3)2, dovresti sciacquare gli occhi e la pelle con acqua e consultare un medico. Puoi anche assumere sali di solfato per ridurre la tossicità del bario.
| Simboli di pericolo | O (ossidante), Xn (nocivo) |
| Descrizione della sicurezza | S13: Tenere lontano da cibi e bevande, comprese quelle destinate agli animali. S17: Tenere lontano da materiali combustibili. S22: Non respirare le polveri. S26: In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico. S36/37/39: Indossare indumenti protettivi, guanti e proteggersi gli occhi/il viso adeguati. |
| Numeri di identificazione delle Nazioni Unite | UN1446 |
| Codice SA | 2834 29 10 |
| Classe di pericolo | 5.1 (Materiali ossidanti) |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto) = 355 mg/kg; LC50 (inalazione, ratto) = 0,15 mg/L/4h |
Metodi per la sintesi del nitrato di bario
È possibile utilizzare diversi metodi per creare Ba(NO3)2, che è una sostanza solida bianca.
Un metodo prevede la reazione del carbonato di bario con l’acido nitrico . Questo produce Ba(NO3)2 e anidride carbonica. Filtrare la soluzione di Ba(NO3)2 per eliminare eventuali impurità di ferro, quindi evaporarla per ottenere cristalli solidi.
Un altro metodo consiste nel far reagire il solfuro di bario con l’acido nitrico . Questo produce Ba(NO3)2 e idrogeno solforato. Per purificare e cristallizzare la soluzione Ba(NO3)2, seguiamo lo stesso processo di prima.
Un terzo metodo prevede la dissoluzione del bario metallico o dell’ossido di bario nell’acido nitrico . Questo produce Ba(NO3)2 e idrogeno o acqua. La soluzione contenente Ba(NO3)2 viene quindi concentrata e sottoposta a cristallizzazione.
Un quarto metodo consiste nell’utilizzare la sintesi del sale fuso. Ciò comporta il riscaldamento di una miscela di Ba(NO3)2 e un vescicante inorganico, come cloruro di ammonio, bicarbonato di sodio o nitrito di sodio. La vescicante si rompe e crea pori nei cristalli di Ba(NO3)2. Ciò li rende più affidabili come ossidanti pirotecnici.
Ecco alcuni metodi per sintetizzare Ba(NO3)2. Usano tutti l’acido nitrico come reagente comune e producono Ba(NO3)2 come prodotto.
Usi del nitrato di bario
Alcuni degli usi di Ba(NO3)2 sono:
- Composti di ossido di bario – Utilizzati nella produzione di materiali contenenti ossido di bario, come ceramica, vetro e tubi a raggi catodici.
- Fiamma Verde – Utilizzata nei semafori verdi e nei fuochi d’artificio perché brucia con una fiamma verde per l’emissione di ioni di bario.
- Rodenticida – Utilizzato come rodenticida per uccidere ratti e topi, poiché è tossico per loro.
- Ossidante – Utilizzato nei detonatori e negli esplosivi, è un potente ossidante che può migliorare la combustione di altre sostanze.
- Primer – Utilizzato negli inneschi e nei proiettili traccianti perché fornisce l’accensione e la visibilità delle munizioni.
- Pigmento – Utilizzato nella produzione di vernici e pigmenti perché può conferire loro un colore bianco o verde.
- Agente ossidante – Utilizzato come agente ossidante in varie reazioni chimiche, come la sintesi del perossido di bario e dell’idrossido di bario.
- Esplosivi – Utilizzati nella produzione di esplosivi come Baratol, che è una miscela di Ba(NO3)2, TNT e legante.
Domande:
D: Il nitrato di bario è solubile?
R: Ba(NO3)2 è solubile in acqua e in alcuni altri solventi, come etanolo, acetone e metanolo.
D: Il nitrato di bario è utile per il calcestruzzo?
R: Ba(NO3)2 non è utile per il calcestruzzo, poiché può causare la corrosione delle armature in acciaio e la fessurazione del calcestruzzo.
D: Si formerà un precipitato se si combinano soluzioni di solfato di potassio e nitrato di bario?
R: Sì, si formerà un precipitato di solfato di bario (BaSO4) se si combinano soluzioni di solfato di potassio (K2SO4) e nitrato di bario (Ba(NO3)2).
D: Il nitrato di bario ha la formula Ba(NO3)2. Quale affermazione è vera sul nitrato di bario?
R: Una possibile affermazione è: Ba(NO3)2 è un composto ionico composto da uno ione bario e due ioni nitrato.
D: Il nitrato di bario è volatile?
R: No, Ba(NO3)2 non è volatile, poiché ha un punto di fusione elevato e si decompone prima dell’ebollizione.
D: Il nitrato di bario è neutro?
R: No, Ba(NO3)2 non è neutro, poiché è un sale acido che può abbassare il pH di una soluzione.
D: Cosa viene prodotto nella reazione di sostituzione di Ba(NO3)2 e Na2SO4?
R: NaNO3 e BaSO4 vengono prodotti durante la reazione di sostituzione di Ba(NO3)2 e Na2SO4.
D: Il Ba(NO3)2 è solubile in acqua?
R: Sì, Ba(NO3)2 è solubile in acqua, poiché si dissolve per formare ioni bario e ioni nitrato.
D: Qual è l’equazione ionica netta per la reazione di MgSO4 con Ba(NO3)2?
R: L’equazione ionica netta per la reazione di MgSO4 con Ba(NO3)2 è:
Ba2+ + SO42- → BaSO4
D: Quante moli ci sono in 432 g di Ba(NO3)2?
R: Il numero di moli in 432 g di Ba(NO3)2 è:
n = m/M, n = 432/261.337, n = 1.653 moli
D: Il Ba(NO3)2 è solubile?
R: Sì, Ba(NO3)2 è solubile, perché si dissolve per formare ioni bario e ioni nitrato.
