Il nitrato di ammonio (NH4NO3) è un composto chimico. Può essere usato come fertilizzante o come esplosivo. È altamente solubile in acqua e igroscopico.
| Nome dell’IUPAC | Nitrato di ammonio |
| Formula molecolare | NH4NO3 |
| numero CAS | 6484-52-2 |
| Sinonimi | Sale di ammonio dell’acido nitrico, Nitrato di ammonio (AN), Nitrato di ammonio, Nitrame, Nitramon |
| InChI | InChI=1S/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1 |
Proprietà del nitrato di ammonio
Formula di nitrato di ammonio
Il nitrato di ammonio è un composto chimico con la formula NH4NO3. È formato da due ioni: ammonio (NH4+) e nitrato (NO3-), tenuti insieme da un legame ionico 2 . È una polvere cristallina bianca facilmente solubile in acqua.
Massa molare del nitrato di ammonio
La massa molare di NH4NO3 è 80,043 g/mol. Può essere calcolato sommando le masse molari dei suoi elementi costitutivi: azoto, idrogeno e ossigeno. La massa molare dell’azoto è 14,0067 g/mol, la massa molare dell’idrogeno è 1,00784 g/mol e la massa molare dell’ossigeno è 15,9999 g/mol.
La massa molare di NH4NO3 = 2 x massa molare di azoto + 4 x massa molare di idrogeno + 3 x massa molare di ossigeno
La massa molare di NH4NO3 = 28.0134 g/mol + 4.03136 g/mol + 47.9997 g/mol
La massa molare di NH4NO3 = 80,043 g/mol
Punto di ebollizione del nitrato di ammonio
NH4NO3 non ha un punto di ebollizione definito. Si decompone ad alte temperature, rilasciando gas come azoto, ossigeno e vapore acqueo. La temperatura di decomposizione di NH4NO3 varia a seconda della purezza, dell’umidità e della presenza di impurità o additivi. La temperatura di decomposizione dell’NH4NO3 puro è di circa 210°C o 483 K.
Punto di fusione del nitrato di ammonio
Il punto di fusione di NH4NO3 è 169,6 ° C o 442,8 K. A questa temperatura subisce una transizione di fase da una struttura cristallina romboedrica a una struttura cristallina cubica. Può anche formare una miscela eutettica con acqua, che ha un punto di fusione inferiore intorno a -16 °C o 257 K.
Densità del nitrato di ammonio g/ml
La densità di NH4NO3 è 1,725 g/ml o 1725 kg/m3 a temperatura e pressione ambiente. È più denso dell’acqua, che nelle stesse condizioni ha una densità di circa 1 g/ml o 1000 kg/m3. La densità di NH4NO3 diminuisce all’aumentare della temperatura, a causa della dilatazione termica.
Peso molecolare del nitrato di ammonio
Il peso molecolare di NH4NO3 è uguale alla sua massa molare, che è 80,043 g/mol. Il peso molecolare è la massa di una mole o 6.022 x 10^(23) molecole di NH4NO3. Il peso molecolare può anche essere espresso in unità di massa atomica (amu), definite come un dodicesimo della massa di un atomo di carbonio-12.
Il peso molecolare di NH4NO3 in amu è 80,043 x (1/12) x (10^(23)) amu
Il peso molecolare di NH4NO3 in amu è di circa 6,669 x 10^(23) amu
Struttura del nitrato di ammonio
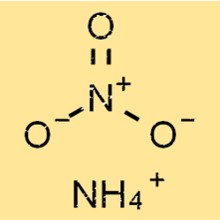
NH4NO3 ha una struttura ionica semplice, composta da ioni ammonio caricati positivamente e ioni nitrato caricati negativamente. Lo ione ammonio ha una forma tetraedrica, con quattro atomi di idrogeno legati ad un atomo di azoto centrale tramite legami covalenti.
NH4+
H
|
HNH
|
H
Lo ione nitrato ha una forma planare trigonale, con tre atomi di ossigeno legati ad un atomo di azoto centrale tramite legami covalenti, uno dei quali è un doppio legame.
Numero 3-
OH
||
OH
Solubilità del nitrato di ammonio
La solubilità di NH4NO3 si riferisce alla quantità di questo composto che si dissolve in acqua o altri solventi. NH4NO3 è molto solubile in acqua e la sua solubilità aumenta con la temperatura. Ad esempio, a 20°C, 150 g di NH4NO3 si possono sciogliere in 100 ml di acqua, ma a 100°C, 1024 g si possono sciogliere nella stessa quantità di acqua. NH4NO3 si dissolve anche in metanolo, etanolo e acetone, ma non in dietil etere o cloroformio. La solubilità di NH4NO3 dipende dalla presenza di altre sostanze, come acidi, basi, sali o composti organici. Alcune di queste sostanze possono influenzare la stabilità di NH4NO3 e provocarne la decomposizione o l’esplosione.
| Aspetto | Solido cristallino bianco |
| Densità specifica | 1.725 |
| Colore | Bianco o grigio |
| Odore | Inodore |
| Massa molare | 80,043 g/mole |
| Densità | 1.725 g/ml o 1725 kg/m3 |
| Punto di fusione | 169,6°C o 442,8K |
| Punto di ebollizione | Circa. 210°C o 483 K (si decompone) |
| Punto flash | Non infiammabile |
| solubilità in acqua | Endotermico, 118 g/100 ml (0 °C), 150 g/100 ml (20 °C), 297 g/100 ml (40 °C), 410 g/100 ml (60 °C), 576 g/100 ml (80 °C), 1024 g/100 ml (100°C) |
| Solubilità | Solubile in acqua, metanolo, etanolo, acetone; insolubile in dietil etere, cloroformio |
| Pressione del vapore | Trascurabile a temperatura ambiente |
| Densità del vapore | Non applicabile (solido) |
| pKa | 9,25 (per NH4+) |
| pH | 5,0-6,0 (soluzione acquosa al 10%) |
Sicurezza e pericoli del nitrato di ammonio
La sicurezza e i pericoli di NH4NO3 sono importanti da conoscere per chiunque maneggi o conservi questo composto chimico. NH4NO3 è un ossidante che può intensificare un incendio e provocare esplosioni se miscelato con materiali combustibili o esposto a calore, urti o contaminazione. NH4NO3 può anche rilasciare gas tossici come ossidi di azoto e ammoniaca quando viene scomposto. Pertanto, le persone dovrebbero seguire queste precauzioni di sicurezza quando maneggiano NH4NO3:
- Conservarlo in un luogo fresco, asciutto e ben ventilato, lontano da fonti di fuoco, sostanze organiche, acidi, metalli e altri materiali incompatibili.
- Indossare indumenti protettivi, guanti e protezioni per gli occhi e il viso durante la manipolazione.
- Evitare la creazione di polvere e utilizzare un’adeguata ventilazione durante il trasferimento.
- Lavare accuratamente le mani e il viso dopo la manipolazione.
- Non ingerire né inalare e consultare un medico in caso di esposizione.
- Informare i soccorritori locali della presenza di NH4NO3 nella struttura e preparare un piano di risposta all’emergenza.
| Simboli di pericolo | O (agente ossidante), Xi (irritante) |
| Descrizione della sicurezza | S17 (tenere lontano da materiali combustibili), S26 (in caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico), S36/37/39 (usare indumenti protettivi, guanti adatti e proteggersi gli occhi/la faccia), S42 (durante la fumigazione/irrorazione, indossare un apparecchio respiratorio adeguato) |
| Numeri di identificazione delle Nazioni Unite | S17 (tenere lontano da materiali combustibili), S26 (in caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico), S36/37/39 (usare indumenti protettivi, guanti adatti e proteggersi gli occhi/la faccia), S42 (durante la fumigazione/irrorazione, indossare un apparecchio respiratorio adeguato) |
| Codice SA | 3102.30 (nitrato di ammonio, anche in soluzione acquosa) |
| Classe di pericolo | 5.1 (agente ossidante) |
| Gruppo di imballaggio | III (pericolo basso) |
| Tossicità | LD50 (orale, ratto) = 2.085-5.300 mg/kg |
Metodi di sintesi del nitrato di ammonio
Per produrre questo composto chimico, ampiamente utilizzato come fertilizzante ed esplosivo, i chimici utilizzano vari metodi di sintesi di NH4NO3. Esistono diversi metodi per sintetizzare NH4NO3, ma i più comuni sono:
- Il processo Haber-Bosch e Ostwald: questo metodo prevede la reazione di azoto e gas idrogeno per formare ammoniaca, quindi l’ossidazione dell’ammoniaca con aria per formare acido nitrico . Per formare NH4NO3, neutralizzano l’ammoniaca e l’acido nitrico. Questo metodo richiede alta temperatura, pressione ed energia ed emette molta anidride carbonica.
- La reazione di metatesi: questo metodo prevede la reazione di un sale di ammonio solubile con un sale di nitrato solubile per formare NH4NO3 e un altro sale. Ad esempio, il solfato di ammonio e il nitrato di bario possono reagire per formare NH4NO3 e solfato di bario. Questo metodo è semplice e non richiede temperatura o pressione elevate, ma produce un sottoprodotto che potrebbe dover essere separato o smaltito.
- Il processo al plasma: questo metodo consiste nell’utilizzare un plasma a bassa temperatura e bassa pressione per fissare l’azoto presente nell’aria nel terreno, formando così NH4NO3 direttamente nel terreno. Questo metodo non richiede gas idrogeno o catalizzatori e non emette anidride carbonica. Può anche arricchire il terreno con azoto e migliorare la crescita delle piante.
Usi del nitrato di ammonio
Ecco alcuni usi di NH4NO3:
- Fertilizzante: NH4NO3 è una fonte comune di azoto per le piante, poiché contiene circa il 33,5% di azoto, il tutto disponibile per l’assorbimento da parte delle piante. I produttori rivestono i pellet di carbonato di ammonio bianchi o grigi con argilla per evitare che si incrostino e assorbano umidità. Possono applicarlo in forma solida o in soluzione perché l’acqua lo dissolve facilmente.
- Esplosivo: NH4NO3 è un agente ossidante che può potenziare la detonazione di altri esplosivi, come nitroglicerina, TNT, RDX o polvere di alluminio. Un esplosivo industriale ampiamente utilizzato, che rappresenta l’80% degli esplosivi utilizzati in Nord America, contiene ANFO (NH4NO3 e olio combustibile) come ingrediente principale. Richiede un potente iniziatore per farlo esplodere quando viene utilizzato in ordigni esplosivi improvvisati, ma può essere utilizzato anche per applicazioni industriali.
- Pirotecnica: i fuochi d’artificio possono utilizzare NH4NO3 per creare vari effetti, come fumo, scintille, stelle e fulmini. Possono essere utilizzati anche impacchi freddi, che producono una reazione endotermica se miscelati con acqua.
- Altri usi: utilizzato come precursore del protossido di azoto (gas esilarante), anestetico e propellente. Gli ossidi di azoto possono essere utilizzati come assorbenti, lieviti e antibiotici possono essere utilizzati come nutrienti e le miscele congelatrici possono essere utilizzate come componenti.
Domande:
D: Da dove viene il fertilizzante al nitrato di ammonio?
R: Il fertilizzante NH4NO3 è un prodotto sintetico risultante dalla reazione di ammoniaca e acido nitrico. L’ammoniaca si ottiene dal gas naturale o da altre fonti e l’acido nitrico viene prodotto ossidando l’ammoniaca con l’aria. Il fertilizzante NH4NO3 può anche essere prodotto utilizzando un processo al plasma che fissa l’azoto presente nell’aria nel terreno.
D: Cos’è il nitrato di ammonio?
R: NH4NO3 è un composto chimico con la formula NH4NO3. È un sale cristallino bianco composto da ioni ammonio e nitrato. È altamente solubile in acqua e igroscopico in forma solida, sebbene non formi idrati.
D: A cosa serve il nitrato di ammonio?
R: NH4NO3 viene utilizzato principalmente per due scopi: come fertilizzante e come esplosivo. Come fertilizzante, fornisce alle piante l’azoto, essenziale per la loro crescita e il loro metabolismo. Essendo un esplosivo, agisce come un ossidante che favorisce la detonazione di altri esplosivi, come l’ANFO (NH4NO3 e olio combustibile) 1 . Può essere utilizzato anche per altri scopi, come la produzione di protossido di azoto (gas esilarante), impacchi freddi, fuochi d’artificio e nutrienti per il lievito.
D: Qual è la formula molecolare del nitrato di ammonio?
R: La formula molecolare del nitrato di ammonio è NH4NO3. Ha una massa molare di 80.043 g/mol e contiene il 35% di azoto in massa.
D: Di cosa è fatto il fertilizzante a base di nitrato di ammonio?
R: Il fertilizzante NH4NO3 è composto da NH4NO3 e talvolta da altri additivi, come argilla, agenti antiagglomeranti o stabilizzanti. La qualità commerciale contiene circa il 33,5% di azoto, il tutto in forme disponibili per l’assorbimento da parte delle piante.
D: Il nitrato di ammonio è un acido o una base?
R: NH4NO3 non è né un acido né una base, ma un sale. Può dissociarsi in acqua in ioni ammonio e nitrato, che possono agire come acidi o basi deboli a seconda del pH della soluzione. Lo ione ammonio ha un pKa di 9,25, il che significa che può donare un protone e agire come un acido in soluzioni basiche. Lo ione nitrato non ha pKa, il che significa che non può donare o accettare protoni, ma può agire come una base, formando acido nitrico con ioni idronio in soluzioni acide.
D: Esplosione di nitrato di ammonio?
R: Un’esplosione di NH4NO3 è una reazione chimica violenta che si verifica quando NH4NO3 si decompone rapidamente e rilascia grandi quantità di gas, come azoto, ossigeno e vapore acqueo. La decomposizione può essere innescata da calore, urti, attrito, contaminazione o confinamento. Un’esplosione di NH4NO3 può causare gravi danni agli edifici, alle persone e all’ambiente. Alcuni esempi di esplosioni di NH4NO3 sono il disastro di Texas City del 1947, l’esplosione di Oppau del 1921, l’esplosione di Tianjin del 2015 e l’esplosione di Beirut del 2020.
D: Come acquistare il nitrato di ammonio?
R: L’acquisto di NH4NO3 potrebbe richiedere una licenza o un permesso a seconda del paese o della regione in cui vivi. Infatti, NH4NO3 può essere utilizzato per realizzare esplosivi o ordigni esplosivi improvvisati che potrebbero rappresentare una minaccia per la sicurezza pubblica. Potrebbe inoltre essere richiesto di fornire la propria identità, indirizzo, dettagli di contatto e uso previsto del prodotto al momento dell’acquisto di NH4NO3. NH4NO3 può essere acquistato da fornitori o distributori approvati che rispettano le normative e gli standard locali. Dovresti anche seguire le linee guida corrette per la conservazione e la gestione per evitare incidenti o uso improprio di NH4NO3.
