Il nitrato d’argento (AgNO3) è un composto chimico composto da argento, azoto e ossigeno. È comunemente usato in fotografia, medicina e come reagente di laboratorio per varie reazioni.
| Nome IUPAC | Nitrato d’argento |
| Formula molecolare | AgNO3 |
| numero CAS | 7761-88-8 |
| Sinonimi | Mononitrato d’argento, sale d’argento (1+) dell’acido nitrico, nitrato d’argento (I). |
| InChI | InChI=1S/Ag.NO3/c;2-1(3)4/q+1;-1 |
Proprietà del nitrato d’argento
Formula di nitrato d’argento
La formula del mononitrato d’argento è AgNO3. È costituito da un atomo di argento (Ag), un atomo di azoto (N) e tre atomi di ossigeno (O). La formula rappresenta il rapporto tra gli atomi in una molecola di mononitrato d’argento.
Massa molare del nitrato d’argento
La massa molare del mononitrato d’argento si calcola sommando le masse atomiche dei suoi elementi costitutivi. L’argento ha una massa atomica di 107,87 g/mol, l’azoto ha una massa di 14,01 g/mol e ciascun atomo di ossigeno ha una massa di 16,00 g/mol. La loro aggiunta dà una massa molare di circa 169,87 g/mol per il mononitrato d’argento.
Punto di ebollizione del nitrato d’argento
Il mononitrato d’argento ha un punto di ebollizione di circa 440 gradi Celsius (824 gradi Fahrenheit). A questa temperatura il composto subisce una transizione di fase dallo stato liquido allo stato gassoso. Il punto di ebollizione indica la temperatura alla quale la tensione di vapore della sostanza eguaglia la pressione atmosferica.
Nitrato d’argento Punto di fusione
Il punto di fusione del mononitrato d’argento è di circa 209 gradi Celsius (408 gradi Fahrenheit). Questa è la temperatura alla quale la forma solida del mononitrato d’argento si trasforma in un liquido. Il punto di fusione è una proprietà caratteristica di una sostanza e aiuta a determinarne il comportamento fisico in diverse condizioni.
Densità del nitrato d’argento g/mL
La densità del mononitrato d’argento è di circa 4,35 g/mL. La densità è una misura della quantità di massa contenuta in un dato volume. Si calcola dividendo la massa di una sostanza per il suo volume. La densità del mononitrato d’argento indica quanto è compatto o quanto è concentrato in uno spazio specifico.
Peso molecolare del nitrato d’argento
Il peso molecolare del mononitrato d’argento, chiamato anche massa molare, è di circa 169,87 g/mol. Rappresenta la somma delle masse atomiche di tutti gli atomi presenti in una molecola di mononitrato d’argento. Il peso molecolare viene utilizzato in vari calcoli e conversioni che coinvolgono quantità del composto.
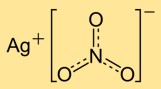
Struttura del nitrato d’argento
Il mononitrato d’argento ha una struttura cristallina composta da cationi argento (Ag+) e anioni nitrato (NO3-). Gli ioni argento sono circondati da ioni nitrato, formando una rete regolare. Questa struttura ionica contribuisce alla stabilità e alle proprietà del composto.
Solubilità del nitrato d’argento
Il mononitrato d’argento è molto solubile in acqua. Si dissolve facilmente in acqua per formare una soluzione limpida e incolore. La solubilità del mononitrato d’argento in acqua è una caratteristica essenziale e svolge un ruolo cruciale in varie applicazioni, come in medicina, fotografia e reazioni chimiche.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 4,35 g/ml |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 169,87 g/mole |
| Densità | 4,35 g/ml |
| Punto di fusione | 209°C (408°F) |
| Punto di ebollizione | 440°C (824°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua e solventi organici come l’etanolo |
| Pressione del vapore | 0,26 mmHg a 25°C (77°F) |
| Densità del vapore | Non applicabile |
| pKa | – |
| pH | Acido (circa pH 5-6 in soluzione acquosa) |
Sicurezza e pericoli del nitrato d’argento
Il mononitrato d’argento presenta alcuni rischi per la sicurezza e occorre prestare attenzione quando si maneggia il composto. È considerato nocivo se ingerito, inalato o se entra in contatto con la pelle o gli occhi. Dovrebbero essere utilizzate misure protettive come guanti, occhiali di sicurezza e camici da laboratorio. Ciò può causare irritazioni, ustioni e macchie sulla pelle e su altre superfici. Se riscaldato, può rilasciare ossidi di azoto tossici. Dovrebbe essere conservato in un luogo fresco e asciutto, lontano da sostanze incompatibili. Le fuoriuscite dovrebbero essere pulite tempestivamente e lo smaltimento dei rifiuti dovrebbe seguire linee guida appropriate per evitare la contaminazione dell’ambiente.
| Simboli di pericolo | Corrosivo, Ossidante |
| Descrizione della sicurezza | Provoca gravi ustioni cutanee e lesioni oculari. |
| Identificatori delle Nazioni Unite | ONU 1493 (Mononitrato d’argento massiccio) |
| Codice SA | 2843.10.00 |
| Classe di pericolo | Classe 5.1 (Materiali ossidanti) |
| Gruppo di imballaggio | GE II (intermedio) |
| Tossicità | Tossico per la vita acquatica con effetti a lungo termine. |
Metodi di sintesi del nitrato d’argento
Esistono diversi metodi per sintetizzare il mononitrato d’argento.
Un metodo comune prevede la reazione tra argento metallico e acido nitrico . In questo processo, l’acido nitrico diluito dissolve l’argento per produrre mononitrato d’argento. Un altro metodo prevede la reazione dell’ossido d’argento o del carbonato d’argento con l’acido nitrico, con conseguente formazione di mononitrato d’argento.
Inoltre, la reazione tra cloruro d’argento e acido nitrico può anche produrre mononitrato d’argento. L’acido nitrico dissolve il cloruro d’argento, spostando gli ioni cloruro e formando mononitrato d’argento.
Inoltre, la reazione del solfato d’argento con un sale nitrato solubile, come il nitrato di sodio, consente l’acquisizione del mononitrato d’argento. Il solfato d’argento reagisce con il sale nitrato in una soluzione acquosa, portando alla formazione di mononitrato d’argento e di un sale solfato solubile.
Quando si implementano questi metodi sintetici, è importante adottare adeguate precauzioni di sicurezza e utilizzare acidi corrosivi e composti potenzialmente tossici. Dovrebbero essere seguiti anche i protocolli e le linee guida di laboratorio per garantire un’accurata preparazione e manipolazione del mononitrato d’argento.
Usi del nitrato d’argento
Il mononitrato d’argento ha molti usi in diversi campi. Ecco alcune applicazioni comuni:
- Fotografia: la fotografia tradizionale in bianco e nero utilizza il mononitrato d’argento come composto sensibile alla luce che reagisce con la luce, formando particelle d’argento e sviluppando immagini fotografiche.
- Medicina: le applicazioni mediche utilizzano il mononitrato d’argento per le sue proprietà antisettiche nella cura delle ferite. La sua applicazione topica previene le infezioni, stimola la guarigione e cura ustioni, ulcere e altre ferite della pelle.
- Reagente di laboratorio: il mononitrato d’argento funge da versatile reagente di laboratorio, consentendo varie reazioni chimiche e viene utilizzato nella chimica analitica per rilevare la presenza di alogenuri e altri composti.
- Placcatura d’argento: i processi di galvanica utilizzano il mononitrato d’argento per depositare attivamente un sottile strato di argento su varie superfici. Questo uso è comune per scopi decorativi e per fornire resistenza alla corrosione.
- Colorazione e colorazione: l’istologia e la microscopia utilizzano il mononitrato d’argento come colorante per migliorare attivamente la visibilità di strutture specifiche nei campioni biologici. L’industria tessile lo utilizza per tingere i tessuti.
- Incisione: la natura corrosiva del mononitrato d’argento ne consente l’uso attivo nell’incisione di motivi su vetro e specchi. Rimuove selettivamente gli strati superficiali, creando motivi complessi.
- Educazione alla chimica: gli istituti scolastici utilizzano attivamente il mononitrato d’argento per eseguire esperimenti e dimostrazioni chimiche, a causa delle sue reazioni distinte e degli effetti visivi.
- Catalizzatore d’argento: in alcune reazioni chimiche, il mononitrato d’argento agisce attivamente come catalizzatore, facilitando la conversione dei reagenti nei prodotti desiderati.
Domande:
D: AgNO3 è solubile in acqua?
R: Sì, AgNO3 è solubile in acqua.
D: Cos’è l’AgNO3?
R: AgNO3 è il mononitrato d’argento, un composto chimico composto da argento, azoto e ossigeno.
D: Quali sono gli ioni spettatori nella reazione tra KCl(aq) e AgNO3(aq)?
R: Nella reazione tra KCl(aq) e AgNO3(aq), gli ioni spettatori sono K+ e NO3-.
D: Quali ioni, se ce ne sono, sono ioni spettatori nella reazione AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)?
R: Nella reazione AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq), gli ioni spettatori sono Na+ e NO3-.
D: Quante moli di Cu sono necessarie per reagire con 5,8 moli di AgNO3?
R: L’equazione bilanciata è necessaria per determinare il numero di moli di Cu necessarie per reagire con 5,8 moli di AgNO3.
D: Quale dei seguenti composti produrrà un precipitato con AgNO3?
R: I composti contenenti ioni Cl-, Br- o I- produrranno un precipitato con AgNO3.
D: AgNO3 è un composto ionico?
R: Sì, AgNO3 è un composto ionico.
D: AgNO3 è un elettrolita forte?
R: Sì, AgNO3 è un potente elettrolita.
D: AgNO3 conduce elettricità?
R: Sì, AgNO3 conduce elettricità quando disciolto in acqua.
D: Il nitrato d’argento è un sale?
R: Sì, il mononitrato d’argento è un sale.
D: Posso acquistare il nitrato d’argento?
R: Sì, il mononitrato d’argento è disponibile in commercio per l’acquisto.
D: Il nitrato d’argento è una soluzione?
R: Il mononitrato d’argento può esistere in forma solida o in soluzione, a seconda delle sue condizioni.
D: Come rimuovere la macchia di nitrato d’argento?
R: Le macchie di mononitrato d’argento possono essere rimosse trattando l’area interessata con un agente riducente delicato, come il perossido di idrogeno o il tiosolfato di sodio.
D: Il nitrato d’argento è solubile in acqua?
R: Sì, il mononitrato d’argento è solubile in acqua.
D: Che precipitato si forma quando si mescolano soluzioni di nitrato d’argento e cromato di potassio?
R: Quando si mescolano soluzioni di mononitrato d’argento e cromato di potassio, si forma un precipitato giallo di cromato d’argento (Ag2CrO4).
D: Qual è la massa molare del nitrato d’argento?
R: La massa molare del mononitrato d’argento (AgNO3) è di circa 169,87 g/mol.
D: L’argento metallico viene aggiunto a una soluzione di nitrato di piombo (II). Qual è la reazione chimica equilibrata?
R: La reazione chimica bilanciata è 2Ag + Pb(NO3)2 → 2AgNO3 + Pb.
