L’n-pentano è un idrocarburo con la formula molecolare C5H12. Viene utilizzato come solvente, combustibile e agente espandente per l’isolamento in schiuma. Il suo punto di ebollizione è 36°C.
| Nome IUPAC | Pentano |
| Formula molecolare | C5H12 |
| numero CAS | 109-66-0 |
| Sinonimi | n-idruro di amile, Skellysolve A, idruro di amile, idruro di pentile, UN 1265 |
| InChI | InChI=1S/C5H12/c1-3-5-4-2/h3-5H2.1-2H3 |
Proprietà dell’n-pentano
Punto di ebollizione del pentano
Il pentano ha un punto di ebollizione di 36,07°C (97,13°F) a pressione standard (1 atm). È un liquido volatile e infiammabile che evapora facilmente a temperatura ambiente. Il suo basso punto di ebollizione lo rende utile come agente espandente per schiume isolanti e come combustibile per motori a combustione interna.
Formula del pentano
La formula chimica del pentano è C5H12. È un alcano a catena lineare e appartiene al gruppo degli idrocarburi. La formula indica il numero e il tipo di atomi presenti in una molecola di pentano. La formula del pentano è importante per determinare il suo comportamento in varie applicazioni, come la sua reattività con altre sostanze.
Massa molare del pentano
La massa molare del pentano, chiamato anche pentano normale, è 72,15 g/mol. È un alcano a catena lineare e ha cinque atomi di carbonio e 12 atomi di idrogeno. La sua massa molare viene calcolata sommando i pesi atomici del carbonio e dell’idrogeno nella molecola. La massa molare del pentano è importante per determinare la quantità di composto necessaria in varie reazioni chimiche.
Punto di fusione del pentano
Il pentano ha un punto di fusione di -129,8°C (-201,6°F). È un liquido incolore a temperatura e pressione ambiente, ma può congelare fino a diventare solido a basse temperature. Il punto di fusione del pentano è importante nel determinare il suo comportamento in varie applicazioni, come la refrigerazione e il trasferimento di calore.
Densità del pentano g/ml
La densità del pentano è 0,63 g/mL a 20°C. È un liquido meno denso dell’acqua e galleggia sulla superficie dell’acqua. La densità del pentano è importante per determinarne il comportamento in varie applicazioni, come la miscelazione con altri liquidi e la sua idoneità come combustibile.
Peso molecolare del pentano
Il peso molecolare del pentano è 72,15 g/mol. È la somma dei pesi atomici di tutti gli atomi in una molecola di pentano. Il peso molecolare del pentano è importante nel determinare il suo comportamento in varie applicazioni, come la sua solubilità in vari solventi.
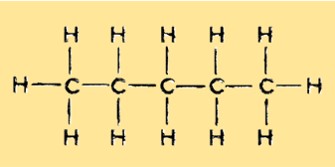
Struttura del pentano
Il pentano ha una struttura lineare e non ramificata con cinque atomi di carbonio e 12 atomi di idrogeno. È un idrocarburo saturo e appartiene al gruppo degli alcani. Ogni atomo di carbonio è legato a due atomi di idrogeno, ad eccezione dei due atomi di carbonio terminali che sono legati a tre atomi di idrogeno.
| Aspetto | Liquido incolore |
| Peso specifico | 0,626 – 0,63 a 20°C |
| Colore | Incolore |
| Odore | Odore di benzina |
| Massa molare | 72,15 g/mole |
| Densità | 0,63 g/ml a 20°C |
| Punto di fusione | -129,8°C (-201,6°F) |
| Punto di ebollizione | 36,07°C (97,13°F) |
| Punto flash | -49°C (-56,2°F) |
| solubilità in acqua | 17,5 mg/l a 20°C |
| Solubilità | Insolubile in acqua, solubile in solventi organici |
| Pressione del vapore | 380 mmHg a 25°C |
| Densità del vapore | 2,5 (aria=1) |
| pKa | ~45 |
| pH | Non applicabile |
Sicurezza e pericoli dell’n-pentano
L’N-pentano è un liquido infiammabile e può formare miscele esplosive con l’aria. Presenta pericolo di incendio ed esplosione e deve essere maneggiato con cura. Può causare irritazione agli occhi, alla pelle e alle vie respiratorie e l’esposizione prolungata può provocare vertigini e mal di testa. È importante utilizzare dispositivi di protezione individuale adeguati quando si maneggia l’n-pentano. In caso di incendio utilizzare mezzi estinguenti adeguati, come anidride carbonica o polvere chimica secca. È inoltre importante conservare l’n-pentano in un’area fresca, ben ventilata e lontana da fonti di ignizione.
| Simboli di pericolo | F, Xi |
| Descrizione della sicurezza | Tenere lontano da fonti di calore/scintille/fiamme libere/superfici calde. Utilizzare solo strumenti antiscintilla. Tieni il contenitore chiuso ermeticamente. Non respirare i vapori. Evitare il contatto con gli occhi, la pelle e gli indumenti. Utilizzare solo in un’area ben ventilata. In caso di incendio utilizzare mezzi estinguenti adeguati. |
| Numeri di identificazione delle Nazioni Unite | UN1265 |
| Codice SA | 2901.10.00 |
| Classe di pericolo | 3 |
| Gruppo di imballaggio | II |
| Tossicità | Può causare irritazione agli occhi, alla pelle e alle vie respiratorie. L’esposizione prolungata può provocare vertigini e mal di testa. |
Metodi per la sintesi dell’n-pentano
La raffinazione del petrolio è il metodo principale per produrre n-pentano. È un idrocarburo a catena lineare e uno dei componenti principali della benzina. Esistono diversi metodi per la sintesi dell’n-pentano:
Cracking del petrolio: per ottenere n-pentano dal petrolio, possiamo crackarlo utilizzando la distillazione frazionata, un processo che riscalda il petrolio greggio per separare i suoi componenti in base al loro punto di ebollizione. Possiamo quindi separare l’n-pentano dagli altri idrocarburi il cui punto di ebollizione è compreso tra 30 e 40°C.
Isomerizzazione: L’isomerizzazione è il processo di conversione di un idrocarburo in un’altra formula avente la stessa molecola ma una struttura diversa. L’isomerizzazione dei penteni produce n-pentano come sottoprodotto. L’industria petrolchimica utilizza comunemente questo metodo.
Idrogenazione: L’idrogenazione del pentene è un altro metodo per sintetizzare l’n-pentano. Per sintetizzare l’n-pentano dai penteni, possiamo reagire con l’idrogeno gassoso in presenza di un catalizzatore, che di solito è un metallo come il nichel o il platino. La reazione produce n-pentano come sottoprodotto.
Disidratazione dell’1-pentanolo: si può anche sintetizzare l’n-pentano dall’1-pentanolo disidratandolo utilizzando un catalizzatore acido come l’acido solforico . Questa reazione produce n-pentene, che può poi essere idrogenato per ottenere n-pentano.
Usi dell’n-pentano
L’N-pentano ha vari usi in vari settori. Ecco alcune delle principali applicazioni:
- Solvente: utilizzato come solvente per oli, cere e resine nell’industria delle vernici e dei rivestimenti. Adesivi, inchiostri e gomma lo utilizzano come solvente.
- Agente espandente: utilizzato come agente espandente nella produzione di isolanti in schiuma, come il polistirene espanso (EPS) e il polistirene estruso (XPS).
- Intermedio chimico: utilizzato come intermedio chimico nella produzione di altri prodotti chimici, come pentanolo, acido pentanoico e pentanale.
- Carburante: utilizzato come carburante in alcune miscele di benzina, solitamente come componente di miscelazione per aumentare i livelli di ottano.
- Standard di calibrazione: utilizzato come standard di calibrazione nella gascromatografia.
- Estrazione: utilizzato nell’estrazione di oli commestibili, come l’olio di soia, e nell’estrazione di prodotti naturali, come gli oli essenziali dalle piante.
- Ricerca di laboratorio: utilizzato nella ricerca di laboratorio come solvente e come materiale di riferimento per la gascromatografia.
Domande:
D: La formula molecolare del pentano è c5h12. qual è la formula molecolare di un isomero del pentano?
R: Il 2-metilbutano (noto anche come isopentano) ha la formula molecolare C5H12 ed è un isomero del pentano.
D: Il pentano è polare?
R: No, il pentano è non polare perché contiene solo legami carbonio-carbonio e carbonio-idrogeno non polari e ha una forma molecolare simmetrica.
D: Quale dei seguenti è più solubile in acqua? acido acetico pentanolo acido butanoico pentanale
R: L’acido acetico è più solubile in acqua grazie alla sua capacità di formare legami idrogeno con le molecole d’acqua.
D: Il pentano è solubile in acqua?
R: No, il pentano è insolubile in acqua a causa della sua natura non polare e della sua incapacità di formare legami idrogeno con le molecole d’acqua.
D: L’n-pentano ha un legame idrogeno?
R: No, l’n-pentano non ha un legame idrogeno perché manca di atomi di idrogeno legati ad atomi elettronegativi come ossigeno, azoto o fluoro.
