L’ossido di magnesio (MgO) è un solido polveroso bianco utilizzato come materiale da costruzione e integratore alimentare. Viene utilizzato anche come antiacido per le sue proprietà basiche (alcaline).
| Nome IUPAC | Ossido di magnesio |
| Formula molecolare | MgO |
| numero CAS | 1309-48-4 |
| Sinonimi | Magnesia, Magnesite, Periclasio |
| InChI | InChI=1S/MgO/c1-2 |
Formula di ossido di magnesio
La formula chimica dell’ossido di magnesio è MgO. Rappresenta uno ione magnesio (Mg2+) e uno ione ossigeno (O2-). La formula indica il rapporto degli elementi presenti nel composto e viene utilizzata per scrivere equazioni chimiche bilanciate per reazioni che coinvolgono l’ossido di magnesio.
Massa molare dell’ossido di magnesio
La massa molare dell’ossido di magnesio è 40,304 g/mol. Si calcola sommando le masse atomiche di ciascun elemento presente nel composto. La massa atomica del magnesio è 24.305 g/mol, mentre quella dell’ossigeno è 16.000 g/mol. La massa molare è importante per determinare la quantità di sostanza presente in un dato campione di ossido di magnesio.
Punto di ebollizione dell’ossido di magnesio
Il punto di ebollizione dell’ossido di magnesio è 2852°C. A questa temperatura la pressione del vapore del solido diventa uguale alla pressione atmosferica e inizia a bollire. L’alto punto di ebollizione dell’ossido di magnesio è dovuto alla sua natura ionica, che richiede una grande quantità di energia per separare gli ioni nella struttura reticolare.
Punto di fusione dell’ossido di magnesio
Il punto di fusione dell’ossido di magnesio è 2800°C. A questa temperatura il solido cambia stato in liquido. L’alto punto di fusione dell’ossido di magnesio è dovuto anche alla sua natura ionica e ai forti legami tra gli ioni nella struttura a rete.
Densità dell’ossido di magnesio g/mL
La densità dell’ossido di magnesio è 3,58 g/mL. Questo valore può essere utilizzato per determinare la quantità di spazio occupato da una data massa di ossido di magnesio. È una proprietà caratteristica del composto ed è utile in varie applicazioni.
Peso molecolare dell’ossido di magnesio
Il peso molecolare dell’ossido di magnesio è 40.304 g/mol. È la somma dei pesi atomici di ciascun elemento presente nel composto. Il peso molecolare è importante per determinare la quantità di sostanza presente in un dato campione di ossido di magnesio.
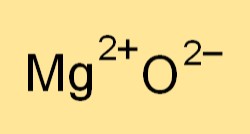
Struttura dell’ossido di magnesio
L’ossido di magnesio ha una struttura reticolare cristallina in cui gli ioni magnesio sono circondati da ioni ossigeno. Gli ioni di magnesio e ossigeno sono tenuti insieme da forti legami ionici, che contribuiscono agli elevati punti di fusione e di ebollizione del composto. La struttura cristallina è un fattore importante nel determinare le proprietà dell’ossido di magnesio, come la sua densità e conduttività termica.
| Aspetto | Solido polverulento bianco |
| Peso specifico | 3,58 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 40,304 g/mole |
| Densità | 3,58 g/ml |
| Punto di fusione | 2800°C |
| Punto di ebollizione | 2852°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Insolubile |
| Solubilità | Solubile in acido |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Alcalino (basico) |
Sicurezza e pericoli dell’ossido di magnesio
L’ossido di magnesio è generalmente considerato sicuro per il consumo umano alle dosi raccomandate e viene utilizzato come integratore alimentare e antiacido. Tuttavia, l’inalazione di alte concentrazioni di polvere di ossido di magnesio può causare irritazione respiratoria e l’esposizione a lungo termine può causare danni ai polmoni. L’ingestione di grandi quantità di ossido di magnesio può causare diarrea, nausea e disturbi addominali. È importante conservare l’ossido di magnesio in un’area asciutta e ben ventilata per evitare l’inalazione di polvere. Evitare il contatto della pelle e degli occhi con l’ossido di magnesio poiché ciò potrebbe causare irritazione. Come con tutti i prodotti chimici, è importante seguire le corrette procedure di manipolazione e sicurezza quando si lavora con l’ossido di magnesio per ridurre al minimo il rischio di lesioni.
| Simboli di pericolo | N / A |
| Descrizione della sicurezza | S26-S36/37/39 |
| Numeri di identificazione delle Nazioni Unite | UN3077, Sostanze pericolose per l’ambiente, solide, nas (ossido di magnesio) |
| Codice SA | 2825.90.90 |
| Classe di pericolo | 9 |
| Gruppo di imballaggio | III |
| Tossicità | Bassa tossicità se ingerito alle dosi raccomandate, può causare irritazione respiratoria se inalato ad alte concentrazioni |
Metodi di sintesi dell’ossido di magnesio
L’ossido di magnesio (MgO) può essere sintetizzato con diversi metodi, tra cui la decomposizione termica, la precipitazione e i processi sol-gel.
La decomposizione termica, nota anche come calcinazione, comporta il riscaldamento del carbonato o dell’idrossido di magnesio ad alte temperature per produrre MgO. Questo metodo è comunemente utilizzato nella produzione di materiali refrattari, nonché nella sintesi di MgO ad elevata purezza per l’industria farmaceutica e chimica.
La precipitazione è un altro metodo per sintetizzare MgO. Questo metodo prevede la reazione di sali di magnesio, come cloruro o solfato di magnesio, con una soluzione alcalina, come idrossido di sodio o idrossido di potassio, per formare MgO. L’MgO precipitato può quindi essere filtrato, lavato ed essiccato per ottenere un prodotto puro.
I processi sol-gel comportano l’idrolisi e la condensazione dei precursori del magnesio, come gli alcossidi di magnesio, per formare MgO. Questo metodo offre il vantaggio di produrre MgO con dimensioni delle particelle uniformi e struttura cristallina ben definita, rendendolo utile per applicazioni nell’industria dei catalizzatori, della ceramica e dell’elettronica.
Nel complesso, il metodo per sintetizzare MgO dipenderà dalla purezza, dalla dimensione delle particelle e dalla struttura cristallina desiderate, nonché dall’applicazione prevista del prodotto MgO. Indipendentemente dal metodo di sintesi, è importante controllare attentamente le condizioni di reazione per evitare la formazione di impurità e ottenere un prodotto MgO di alta qualità.
Usi dell’ossido di magnesio
L’ossido di magnesio (ossido di magnesio) ha una vasta gamma di applicazioni grazie alla sua stabilità chimica, all’elevata conduttività termica e alle proprietà di isolamento elettrico. Alcuni degli usi più comuni dell’ossido di magnesio includono:
- L’ossido di magnesio (MgO) ha un’ampia gamma di usi grazie alla sua stabilità chimica, all’elevata conduttività termica e alle proprietà di isolamento elettrico.
- L’industria dell’edilizia e delle costruzioni utilizza l’MgO come materiale resistente al fuoco e nella produzione di materiali refrattari.
- L’industria farmaceutica utilizza MgO come integratore alimentare e antiacido per neutralizzare l’acido dello stomaco.
- MgO funge da fonte di magnesio nella produzione di altri composti di magnesio, come l’idrossido di magnesio e il carbonato di magnesio.
- L’industria chimica utilizza MgO come catalizzatore in varie reazioni, inclusa la produzione di gomma sintetica, plastica e resine.
- Le industrie agricole utilizzano MgO come ammendante del suolo per migliorare la fertilità del suolo e fornire magnesio essenziale per la crescita delle piante.
- La capacità dell’MgO di adsorbire metalli pesanti e sostanze tossiche lo rende utile per la bonifica ambientale.
- L’industria ceramica utilizza MgO come materia prima nella produzione di ceramiche, isolanti elettrici, materiali refrattari e isolamenti ad alta temperatura.
- L’industria elettronica utilizza MgO nella produzione di dispositivi elettronici come condensatori e transistor grazie alla sua elevata costante dielettrica e alla bassa perdita tangente.
Nel complesso, l’ossido di magnesio è un materiale versatile che ha molte applicazioni grazie alla sua combinazione unica di proprietà chimiche e fisiche.
Domande:
Cosa descrive meglio un composto come l’ossido di magnesio?
L’ossido di magnesio (MgO) si forma come un composto ionico.
Il magnesio metallico dona elettroni all’ossigeno non metallico, creando ioni di magnesio con carica positiva (Mg2+) e ioni di ossido con carica negativa (O2-). Questi ioni si legano ionicamente attraverso una forte attrazione elettrostatica, dando vita ad una struttura cristallina solida.
I composti ionici presentano punti di fusione e di ebollizione elevati, solidità a temperatura ambiente, buona conduttività elettrica allo stato fuso o disciolto e insolubilità nella maggior parte dei solventi. Queste caratteristiche differenziano i composti ionici dai composti molecolari, che si formano mediante legame covalente e hanno punti di fusione e di ebollizione inferiori, scarsa conduttività elettrica e solubilità in molti solventi.
Quale composto ionico viene utilizzato come materiale da costruzione? sale calcareo ossido di magnesio ossido di ferro
Il sale calcareo non è un composto ionico, ma lo sono l’ossido di magnesio e l’ossido di ferro.
Come materiali da costruzione vengono utilizzati l’ossido di magnesio (MgO) e l’ossido di ferro. L’MgO forma pareti e divisori ignifughi e funge da componente nei materiali refrattari per applicazioni ad alta temperatura. L’ossido di ferro, noto anche come ematite, conferisce ai mattoni, al cemento e alla ceramica un colore bruno-rossastro come pigmento. L’ematite funge anche da catalizzatore nelle reazioni chimiche e funge da materiale magnetico in varie tecnologie.
