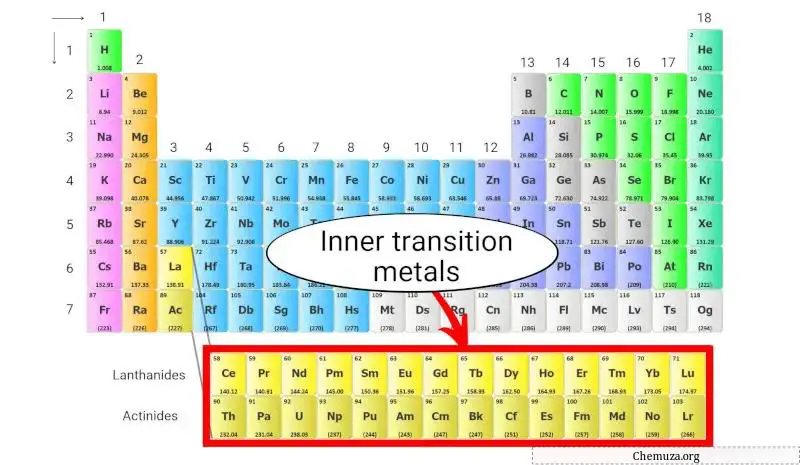
I metalli di transizione interni sono un gruppo di elementi chimici situati nelle due righe inferiori della tavola periodica , appena sotto il blocco principale dei metalli di transizione .
I metalli di transizione interna si dividono in due gruppi:
- Lantanidi , che hanno numeri atomici compresi tra 57 e 71, e
- Attinidi , che hanno numeri atomici compresi tra 89 e 103.
Esploriamo più elementi di transizione interni della tavola periodica.
Cosa sono i metalli di transizione interna? E perché sono posizionati in basso?
I metalli di transizione interna costituiscono il gruppo di elementi posti in fondo alla tavola periodica.
Questi metalli di transizione interni sono solo una parte dei metalli di transizione e hanno anche proprietà simili ai metalli di transizione. Ma sono collocati nella sezione interna come estensione del gruppo 3.
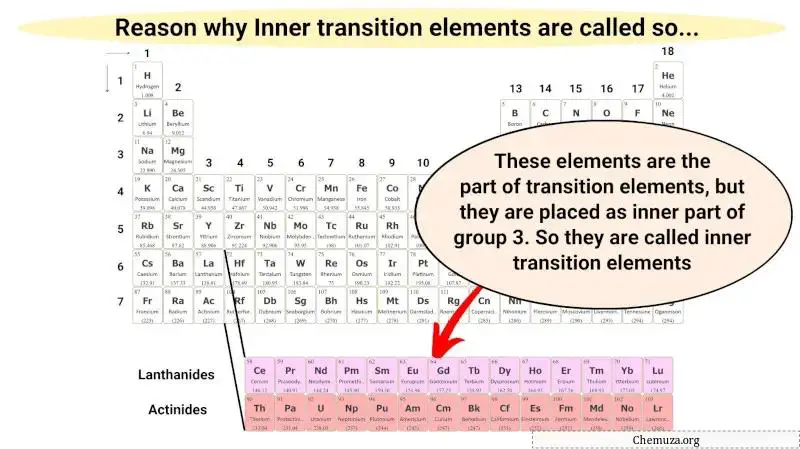
Pertanto, questi elementi metallici sono chiamati metalli di transizione interna.
Perché si trovano in fondo alla tavola periodica?
Se i metalli di transizione interni fossero posti come estensione del gruppo 3, allora la tavola periodica apparirebbe molto lunga (come mostrato sotto).

Quindi, per adattarlo al formato carta A4, le 2 file di metalli di transizione interni sono posizionate nella parte inferiore.
Inoltre, questi elementi di transizione interni hanno i loro elettroni di valenza nell’orbitale f , per cui questi elementi presentano proprietà chimiche simili.
È per questi motivi che i metalli di transizione interna si collocano in fondo alla tavola periodica.
Elenco dei metalli di transizione interna
L’elenco dei metalli di transizione interna è riportato di seguito.
| Numero atomico | Simbolo | Nome e simbolo dell’elemento |
| 57 | Là | Lantanio |
| 58 | Questo | Cerio |
| 59 | Il prof | Praseodimio |
| 60 | SD | Neodimio |
| 61 | PM | Promezio |
| 62 | Poco | Samario |
| 63 | NOI | Europio |
| 64 | Dio | Gadolinio |
| 65 | tubercolosi | Terbio |
| 66 | Dy | Disprosio |
| 67 | Ho | Olmio |
| 68 | Eh | Erbio |
| 69 | TM | Tulio |
| 70 | Sì | Itterbio |
| 71 | Leggere | Lutezio |
| 89 | AC | Attinio |
| 90 | Gi | Torio |
| 91 | Pennsylvania | Protoattinio |
| 92 | tu | Uranio |
| 93 | N.P | Nettunio |
| 94 | Potevo | Plutonio |
| 95 | Sono | Americio |
| 96 | cm | Curio |
| 97 | B.K. | Berkelio |
| 98 | Vedere | California |
| 99 | È | Einsteinio |
| 100 | FM | fermio |
| 101 | Maryland | Mendelevio |
| 102 | NO | Nobelio |
| 103 | L/R | Lawrence |
Fatti sui metalli di transizione interni
Ecco alcuni fatti interessanti sui metalli di transizione interna:
- Esistono due tipi di metalli di transizione interna: lantanidi e attinidi. I lantanidi sono i 15 elementi con numeri atomici compresi tra 57 ( lantanio ) e 71 ( lutezio ), mentre gli attinidi sono i 15 elementi con numeri atomici compresi tra 89 ( attinio ) e 103 ( lawrenzio ).
- I metalli di transizione interna hanno configurazioni elettroniche uniche a causa della presenza di orbitali f. Ciò si traduce in proprietà chimiche e fisiche insolite, come punti di fusione e di ebollizione elevati, formazione di ioni complessi e paramagnetismo.
- La maggior parte dei metalli di transizione interna sono radioattivi e alcuni sono stati utilizzati nei reattori e nelle armi nucleari.
- I metalli di transizione interna sono importanti nella tecnologia e nell’industria. Ad esempio, il neodimio e il samario vengono utilizzati per realizzare potenti magneti [1] e il cerio viene utilizzato nei convertitori catalitici per ridurre le emissioni dei veicoli. [2]
- I lantanidi sono anche chiamati “elementi delle terre rare” perché sono relativamente rari nella crosta terrestre. Tuttavia, in realtà non sono rari e si trovano in molti minerali.
- Gli attinidi sono tutti radioattivi e alcuni, come l’uranio e il plutonio , sono importanti per l’energia nucleare e le armi. Tuttavia, comportano anche rischi per l’ambiente e la salute a causa della loro radioattività.
- I metalli di transizione interna sono conosciuti fin dall’antichità e venivano utilizzati per gioielli e decorazioni. Tuttavia, non furono ampiamente studiati o compresi fino al XX secolo.
Proprietà dei metalli di transizione interna
Ecco alcune proprietà dei metalli di transizione interna:
- Configurazione elettronica: i metalli di transizione interna hanno orbitali f parzialmente riempiti, conferendo loro configurazioni elettroniche uniche e proprietà chimiche e fisiche insolite.
- Punti di fusione e di ebollizione elevati: i metalli di transizione interna hanno punti di fusione e di ebollizione elevati a causa del forte legame metallico derivante dalla presenza di elettroni spaiati negli orbitali f.
- Paramagnetismo: i metalli di transizione interna sono paramagnetici, nel senso che sono attratti da un campo magnetico a causa della presenza di elettroni spaiati negli orbitali f.
- Formazione di ioni complessi: i metalli di transizione interna possono formare ioni complessi a causa della disponibilità di orbitali f vuoti, che possono accogliere elettroni di altri atomi o molecole.
- Radioattività: molti metalli di transizione interna sono radioattivi a causa della presenza di isotopi instabili nei loro nuclei.
- Stati di ossidazione: i metalli di transizione interna mostrano una gamma di stati di ossidazione, inclusi stati di ossidazione elevati, a causa della disponibilità di più elettroni di valenza negli orbitali f.
- Proprietà chimiche simili: i lantanidi e gli attinidi hanno proprietà chimiche simili, il che li rende difficili da separare gli uni dagli altri.
- Lucentezza metallica: i metalli di transizione interna sono generalmente lucenti e hanno una lucentezza metallica a causa della loro elevata riflettività della luce.
Usi dei metalli di transizione interna
I metalli di transizione interna hanno una vasta gamma di usi grazie alle loro proprietà uniche. Alcuni degli usi dei metalli di transizione interna sono:
- Energia nucleare: molti metalli di transizione interna, in particolare gli attinidi come l’uranio, vengono utilizzati come combustibile per reattori e armi nucleari.
- Magneti: i lantanidi come neodimio, samario e gadolinio vengono utilizzati per creare potenti magneti per una varietà di applicazioni, inclusi dischi rigidi di computer, turbine eoliche e macchine per risonanza magnetica.
- Illuminazione: i lantanidi come l’europio e il terbio vengono utilizzati per produrre fosfori per l’illuminazione fluorescente e a LED. [3]
- Catalisi: i lantanidi come il cerio sono utilizzati come catalizzatori in molti processi industriali, tra cui la raffinazione del petrolio e il controllo dell’inquinamento.
- Produzione del vetro: i lantanidi come l’erbio e l’itterbio vengono utilizzati per colorare il vetro, mentre il cerio viene utilizzato per lucidare il vetro.
- Imaging medico: i lantanidi come il gadolinio e il terbio vengono utilizzati negli agenti di contrasto per le scansioni MRI. [4]
- Elettronica: i lantanidi come il disprosio e il terbio sono utilizzati nei dispositivi elettronici, come i filtri a microonde e gli schermi LCD.
- Difesa: i metalli di transizione interna sono utilizzati nelle tecnologie di difesa, comprese le armi nucleari e le munizioni perforanti.
Riepilogo
I metalli di transizione interni sono un gruppo di elementi chimici situati nelle due righe inferiori della tavola periodica, appena sotto il blocco principale dei metalli di transizione.
Si dividono in due gruppi: i Lantanidi e gli Attinidi, che hanno numeri atomici compresi rispettivamente tra 57 e 71 e tra 89 e 103.
La posizione dei metalli di transizione interni è nella parte inferiore della tavola periodica perché i loro elettroni di valenza si trovano nell’orbitale f, che ha proprietà chimiche simili.
I metalli di transizione interna hanno punti di fusione e di ebollizione elevati, formazione di ioni complessi e paramagnetismo. Presentano anche una gamma di stati di ossidazione, inclusi stati di ossidazione elevata, a causa della disponibilità di più elettroni di valenza negli orbitali f.
