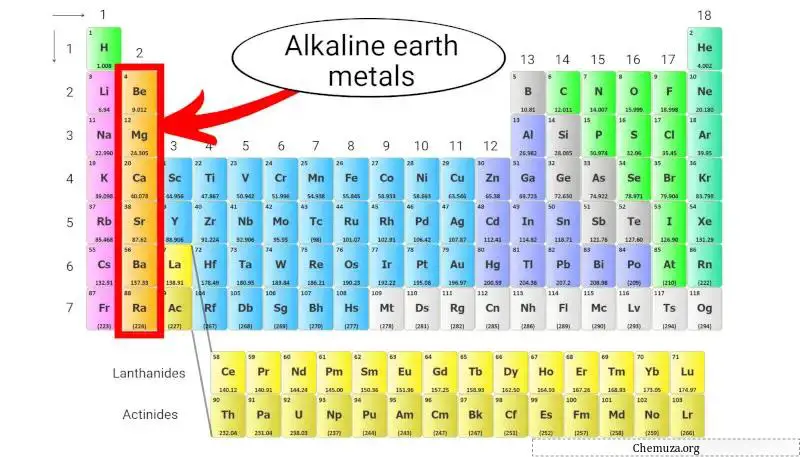
I metalli alcalino terrosi sono un gruppo di elementi situati nella seconda colonna della tavola periodica . Includono berillio (Be), magnesio (Mg), calcio (Ca), stronzio (Sr), bario (Ba) e radio (Ra).
Questi metalli hanno due elettroni nel loro guscio più esterno, [1] il che li rende chimicamente reattivi ma non così reattivi come i metalli alcalini , che si trovano nella prima colonna.
Esploriamo di più sui metalli alcalino terrosi nella tavola periodica.
Cosa sono i metalli alcalino terrosi?

I metalli alcalino terrosi fanno parte del gruppo 2 della tavola periodica e hanno due caratteristiche particolari.
- Quando reagiscono con l’acqua, producono idrossidi di natura alcalina o basica.
- I loro minerali ossidi (BeO, magnesite, MgO, berillo, ecc.) si trovano principalmente nella crosta terrestre e sono stabili al calore.
Spiegazione
Quando i metalli alcalino terrosi (Mg, Ca, Sr, Ba e Ra) reagiscono con l’acqua, formano idrossidi di natura alcalina (o basica). [2]
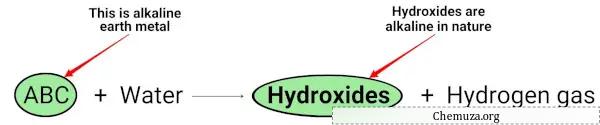
Puoi vedere nell’equazione chimica sopra che i metalli alcalini danno idrossidi che sono di natura basica (con un pH> 7) e rilasciano gas idrogeno.
Per esempio:
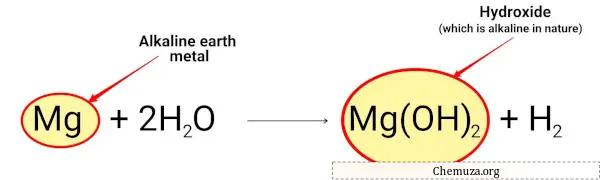
Il magnesio reagisce con l’acqua e forma idrossido di magnesio che è di natura alcalina.
Inoltre, questi metalli si trovano principalmente nella crosta terrestre (come ossidi) e questi minerali ossidati sono stabili al calore. [2]
Questi due criteri danno a questi metalli il nome di “metalli alcalino terrosi”.
(Nota: è importante notare che il berillio, che è anche un elemento del Gruppo 2, non forma una soluzione alcalina quando reagisce con l’acqua. Invece, i suoi idrossidi mostrano un comportamento anfotero, il che significa che possono comportarsi come un acido o una base Pertanto, il berillio non è considerato un metallo alcalino terroso anche se appartiene allo stesso gruppo.)
Cosa hanno in comune tutti i metalli alcalino terrosi?
I metalli alcalino terrosi condividono diversi tratti comuni.
Ad esempio, entrambi hanno due elettroni di valenza nel loro livello energetico più esterno, il che li rende piuttosto reattivi.
Questa reattività è dovuta alla tendenza a perdere questi elettroni durante le reazioni chimiche, con conseguente formazione di cationi con carica +2.
Inoltre, tutti i metalli alcalino-terrosi hanno un aspetto bianco-argenteo lucido.

Quindi queste sono le due cose principali che i metalli alcalino terrosi hanno in comune.
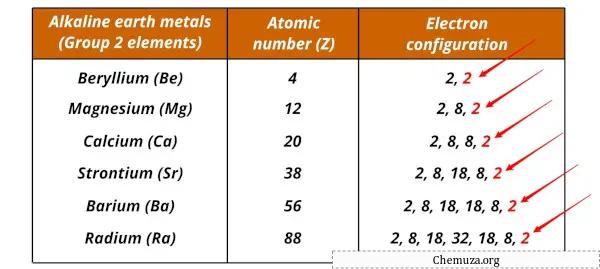
Elenco dei metalli alcalini e loro configurazioni elettroniche
Di seguito sono mostrati i metalli alcalino terrosi e le loro configurazioni elettroniche.
| Elemento | Configurazione elettronica |
| Berillio (Be) | [Lui] 2s 2 |
| Magnesio (Mg) | [Fai] 3 secondi 2 |
| Calcio (Ca) | [Ar] 4s 2 |
| Stronzio (Sr) | [Kr] 5s 2 |
| Bario (Ba) | [Xe] 6s 2 |
| Radio (Ra) | [Rn] 7s 2 |
Tendenze periodiche dei metalli alcalino terrosi
Man mano che si scende nel gruppo dei metalli alcalino terrosi della tavola periodica, si possono osservare le seguenti tendenze:
- Valenza: tutti i metalli alcalino terrosi hanno la stessa valenza di +2. Quindi non vi è alcun cambiamento di valenza man mano che si scende nel gruppo.
- Dimensione atomica: la dimensione atomica dei metalli alcalino-terrosi aumenta man mano che si scende nel gruppo. Questo perché il numero degli strati elettronici (o orbite ) aumenta e l’ effetto schermante degli elettroni interni riduce l’attrazione tra il nucleo e gli elettroni più esterni.
- Carattere metallico: il carattere metallico dei metalli alcalino terrosi aumenta man mano che si scende nel gruppo. Questo perché gli atomi diventano più grandi e contengono più elettroni, rendendoli più facilmente in grado di perdere elettroni e formare ioni positivi.
- Elettronegatività: l’ elettronegatività dei metalli alcalino terrosi diminuisce man mano che si scende nel gruppo. Questo perché gli atomi diventano più grandi e hanno più gusci elettronici, rendendo più difficile per loro attrarre gli elettroni a sé.
- Affinità elettronica: l’affinità elettronica dei metalli alcalino terrosi è generalmente bassa e diminuisce man mano che si scende nel gruppo.
- Energia di ionizzazione: L’energia di ionizzazione dei metalli alcalino terrosi diminuisce man mano che si scende nel gruppo. Questo perché gli atomi più grandi hanno più gusci elettronici e gli elettroni più esterni sono più lontani dal nucleo, il che li rende più facili da rimuovere.
Riepilogo
I metalli alcalino terrosi includono berillio, magnesio, calcio, stronzio, bario e radio. Hanno due elettroni nel loro guscio più esterno, il che li rende reattivi ma meno reattivi dei metalli alcalini.
Questi metalli producono idrossidi alcalini quando reagiscono con l’acqua e contengono minerali ossidati termostabili. Le principali caratteristiche comuni a tutti i metalli alcalino terrosi sono avere due elettroni di valenza, essere bianco argenteo e lucido e formare cationi con carica +2.
La valenza rimane la stessa scendendo nel gruppo, ma la dimensione atomica e il carattere metallico aumentano, mentre l’elettronegatività, l’affinità elettronica e l’energia di ionizzazione diminuiscono.
