L’idruro di litio è un composto costituito da litio e idrogeno. È altamente reattivo e ampiamente utilizzato in varie applicazioni, tra cui lo stoccaggio di energia e le reazioni nucleari.
| Nome IUPAC | Idruro di litio |
| Formula molecolare | LiH |
| numero CAS | 7580-67-8 |
| Sinonimi | Monoidruro di litio, litano, idruro di litio, idruro di litio |
| InChI | InChI=1S/Li.H |
Proprietà dell’idruro di litio
Formula di idruro di litio
La formula del monoidruro di litio è LiH. È costituito da un atomo di litio legato a un atomo di idrogeno. Questa formula semplice e concisa rappresenta la composizione elementare del monoidruro di litio.
Massa molare dell’idruro di litio
La massa molare del monoidruro di litio viene calcolata sommando le masse atomiche del litio (Li) e dell’idrogeno (H). Ciò corrisponde a circa 7,95 grammi per mole (g/mol). La massa molare è essenziale per vari calcoli in chimica, come determinare la quantità di sostanza in un dato campione.
Punto di ebollizione dell’idruro di litio
Il monoidruro di litio ha un punto di ebollizione elevato di circa 1.350 gradi Celsius (2.462 gradi Fahrenheit). Ciò indica che è necessaria una quantità significativa di energia per convertire il composto solido allo stato gassoso.
Punto di fusione dell’idruro di litio
Il punto di fusione del monoidruro di litio è piuttosto alto, intorno ai 688 gradi Celsius (1.270 gradi Fahrenheit). Questa temperatura rappresenta il punto in cui il composto solido si trasforma in uno stato liquido dopo il riscaldamento.
Densità dell’idruro di litio g/mL
La densità del monoidruro di litio è di circa 0,82 grammi per millilitro (g/mL). Questo valore indica che il monoidruro di litio è un composto relativamente denso, il che significa che ha una grande massa per unità di volume.
Peso molecolare dell’idruro di litio
Il peso molecolare del monoidruro di litio viene determinato aggiungendo i pesi atomici di litio e idrogeno. Ciò corrisponde a circa 7,95 grammi per mole (g/mol). Il peso molecolare è fondamentale in vari calcoli chimici, soprattutto nel determinare la stechiometria delle reazioni.
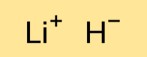
Struttura dell’idruro di litio
Il monoidruro di litio ha una struttura cristallina in cui i cationi litio (Li+) e gli anioni idruro (H-) sono disposti in un reticolo tridimensionale. Gli atomi di litio e idrogeno sono tenuti insieme da forti legami ionici.
Solubilità dell’idruro di litio
Il monoidruro di litio è scarsamente solubile in acqua. Reagisce con l’acqua per formare idrossido di litio (LiOH) e idrogeno gassoso (H2). Questa solubilità limitata è dovuta alla natura altamente ionica del monoidruro di litio, che lo rende meno probabile che si dissolva in solventi polari come l’acqua.
| Aspetto | Solido bianco |
| Peso specifico | 0,82 |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 7,95 g/mole |
| Densità | 0,82 g/ml |
| Punto di fusione | 688°C (1270°F) |
| Punto di ebollizione | 1350°C (2462°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce con l’acqua per formare idrossido di litio (LiOH) e gas idrogeno (H2). |
| Solubilità | Scarsamente solubile |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli dell’idruro di litio
Il monoidruro di litio presenta diversi rischi per la sicurezza. Reagisce violentemente con l’acqua, liberando gas idrogeno infiammabile e producendo idrossido di litio corrosivo. Il contatto con l’umidità o l’aria può provocare la formazione di gas idrogeno altamente infiammabile. Deve essere maneggiato con estrema cautela per evitare accensioni o esplosioni accidentali. Il composto è anche molto reattivo con gli acidi, rilasciando gas idrogeno tossico. Il monoidruro di litio può causare gravi irritazioni alla pelle e agli occhi e l’inalazione della sua polvere o dei suoi fumi può causare difficoltà respiratorie. Quando si lavora con il monoidruro di litio è necessario indossare dispositivi di protezione adeguati, come guanti e occhiali protettivi, e conservarli in un’area asciutta e ben ventilata.
| Simboli di pericolo | Infiammabile, Corrosivo |
| Descrizione della sicurezza | Molto reattivo e infiammabile. Maneggiare con estrema cautela. Evitare il contatto con acqua, aria e acidi. |
| Numeri di identificazione delle Nazioni Unite | ONU 1414 |
| Codice SA | 2850.00.10 |
| Classe di pericolo | 4.3 (Pericoloso se bagnato) |
| Gruppo di imballaggio | Io (Grande pericolo) |
| Tossicità | Tossico per ingestione o inalazione. Può causare gravi irritazioni alla pelle e agli occhi. |
Metodi di sintesi dell’idruro di litio
Vari metodi possono essere utilizzati per sintetizzare il monoidruro di litio.
Un metodo comune prevede la combinazione diretta di litio metallico con gas idrogeno. La reazione avviene a temperature elevate, tipicamente superiori a 600 gradi Celsius (1.112 gradi Fahrenheit), in un ambiente controllato. Il litio metallico reagisce con l’idrogeno gassoso per formare monoidruro di litio.
Un altro metodo è la riduzione della litio ammide (LiNH2) con litio metallico. Questa reazione avviene a temperature più basse, intorno ai 350-400 gradi Celsius (da 662 a 752 gradi Fahrenheit). La reazione dell’ammide di litio con il litio metallico produce monoidruro di litio.
La sintesi del monoidruro di litio può avvenire anche combinando il boroidruro di litio (LiBH4) con il monoidruro di litio stesso. La reazione avviene a temperature elevate, solitamente intorno ai 400 gradi Celsius (752 gradi Fahrenheit). Questo metodo consente la formazione di monoidruro di litio da boroidruro di litio facilmente disponibile.
Inoltre, l’idruro di litio alluminio (LiAlH4) funge da materia prima per la sintesi del monoidruro di litio. In condizioni controllate, il litio alluminio idruro reagisce con il litio metallico, dando luogo alla formazione di monoidruro di litio.
Va notato che questi metodi richiedono un’attenta manipolazione e un rigoroso controllo delle condizioni di reazione a causa della natura altamente reattiva del monoidruro di litio. Durante il processo di sintesi è necessario seguire precauzioni di sicurezza, come lavorare in un’atmosfera inerte e utilizzare dispositivi di protezione adeguati.
Usi dell’idruro di litio
Il monoidruro di litio trova varie applicazioni grazie alle sue proprietà e reattività uniche. Ecco alcuni dei suoi usi:
- Il monoidruro di litio consente lo sviluppo di sistemi avanzati di stoccaggio dell’idrogeno, facilitando soluzioni di stoccaggio dell’energia efficienti e compatte.
- Nelle reazioni nucleari agisce come fonte di neutroni e trova applicazione negli impianti di ricerca e nelle centrali nucleari.
- La sintesi organica utilizza il monoidruro di litio come potente agente riducente per ridurre vari gruppi funzionali.
- Genera gas idrogeno attraverso la reazione con acqua o acidi, rendendolo prezioso per la produzione di idrogeno in loco.
- Se combinato con altri propellenti, il monoidruro di litio contribuisce alla produzione di energia e alla spinta dei motori a razzo.
- Il monoidruro di litio svolge un ruolo nella produzione di gas deuterio, che trova applicazioni nella produzione di energia nucleare e nella ricerca scientifica.
- I processi idrometallurgici utilizzano il monoidruro di litio per produrre vari metalli come titanio e zirconio.
- Serve come precursore o reagente nella sintesi chimica, contribuendo alla formazione di composti organici e inorganici.
- Alcune formulazioni pirotecniche utilizzano il monoidruro di litio per generare calore e gas intensi durante la reazione.
- Le reazioni di idrogenazione utilizzano il monoidruro di litio per aggiungere idrogeno ai composti insaturi, formando così composti saturi.
Queste diverse applicazioni evidenziano la versatilità e l’importanza del monoidruro di litio in molteplici settori e attività scientifiche.
Domande:
D: Qual è la formula dell’idruro formato dal litio?
R: La formula per il monoidruro formato dal litio è LiH.
D: L’idruro di litio riduce i doppi legami?
R: Sì, il monoidruro di litio può ridurre i doppi legami nei composti organici.
D: Cosa riduce l’idruro di litio?
R: LiH è un potente agente riducente comunemente utilizzato per ridurre vari gruppi funzionali nella sintesi organica.
D: L’idruro di litio è ionico o covalente?
R: Il monoidruro di litio è un composto ionico composto da cationi Li+ e anioni H-.
D: Qual è la differenza tra le batterie agli ioni di litio e le batterie al nichel-metallo idruro?
R: Le batterie agli ioni di litio offrono una maggiore densità di energia, una maggiore durata e un peso inferiore rispetto alle batterie al nichel-metallo idruro.
D: Qual è il meccanismo dell’idruro di litio?
R: Il meccanismo del monoidruro di litio varia a seconda della sua reazione e applicazione specifica. Può agire come agente riducente o reagire con acqua, acidi o altri composti.
D: L’idruro di litio è un nucleofilo?
R: Sì, il monoidruro di litio può agire come nucleofilo in alcune reazioni chimiche.
D: Quali elementi crea l’idruro di litio?
R: Il monoidruro di litio viene utilizzato principalmente in applicazioni industriali, come sistemi di accumulo di energia, reazioni nucleari, produzione di idrogeno e sintesi chimica.
D: L’idruro di litio riduce gli alcoli?
R: Il monoidruro di litio può ridurre gli alcoli nei corrispondenti alcani o aldeidi a seconda delle condizioni di reazione e di altri fattori.
