L’isobutilene (C₄H₈) è un gas incolore utilizzato nella produzione di carburanti e prodotti chimici. È altamente infiammabile e ha un odore dolce.
| Nome IUPAC | 2-metilpropene |
| Formula molecolare | C₄H₈ |
| numero CAS | 115-11-7 |
| Sinonimi | Isobutene, 2-metilpropene, metilpropene |
| InChI | InChI=1S/C4H8/c1-4(2)3/h1H2.2-3H3 |
Proprietà dell’isobutilene
Formula dell’isobutilene
La formula dell’isobutene è C₄H₈. È composto da quattro atomi di carbonio e otto atomi di idrogeno. Questa formula molecolare rappresenta la composizione dell’isobutene, mostrando il numero di ciascun tipo di atomo presente in una molecola.
Massa molare dell’isobutilene
La massa molare dell’isobutene si calcola sommando le masse atomiche dei suoi atomi costituenti. Ciò corrisponde a circa 56,11 grammi per mole (g/mol). La massa molare è un parametro cruciale nei calcoli chimici e viene utilizzato per determinare la quantità di una sostanza presente in una determinata quantità.
Punto di ebollizione dell’isobutilene
L’isobutilene ha un punto di ebollizione di circa -6,9 gradi Celsius. Il punto di ebollizione si riferisce alla temperatura alla quale una sostanza passa dalla fase liquida a quella gassosa sotto la pressione atmosferica standard. L’isobutilene vaporizza a questa temperatura e si trasforma in un gas.
Punto di fusione dell’isobutilene
Il punto di fusione dell’isobutene è di circa -140,3 gradi Celsius. Il punto di fusione è la temperatura alla quale una sostanza solida passa allo stato liquido. L’isobutilene subisce questo cambiamento quando riscaldato alla temperatura specificata.
Densità dell’isobutilene g/mL
La densità dell’isobutene è di circa 0,588 grammi per millilitro (g/mL). La densità rappresenta la massa per unità di volume di una sostanza. Determina il grado di densità delle molecole in un dato volume di materiale.
Peso molecolare dell’isobutilene
Il peso molecolare dell’isobutene è di circa 56,11 grammi per mole (g/mol). Il peso molecolare è la somma dei pesi atomici di tutti gli atomi presenti in una molecola. È essenziale per vari calcoli, inclusa la stechiometria e la determinazione della proporzione di diversi elementi in un composto.
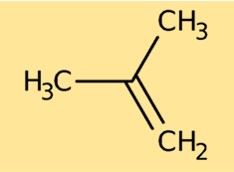
Struttura dell’isobutilene
L’isobutene ha una struttura costituita da una catena ramificata di quattro atomi di carbonio. Ogni atomo di carbonio è legato ad altri atomi, in particolare agli atomi di idrogeno. La struttura è rappresentata da CH₃C(CH₃)CH₂. Questa disposizione degli atomi determina le proprietà chimiche e fisiche dell’isobutene.
Solubilità dell’isobutilene
L’isobutene è scarsamente solubile in acqua. Presenta una bassa solubilità a causa della sua natura non polare. I composti non polari come l’isobutene non si dissolvono facilmente in solventi polari come l’acqua. Tuttavia, l’isobutene può dissolversi in solventi organici come alcoli, eteri e idrocarburi.
| Aspetto | Gas incolore |
| Peso specifico | 0,588 |
| Colore | N / A |
| Odore | Morbido |
| Massa molare | 56,11 g/mole |
| Densità | 0,588 g/ml |
| Punto di fusione | -140,3°C |
| Punto di ebollizione | -6,9°C |
| Punto flash | -49°C |
| solubilità in acqua | Scarsamente solubile |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | 215 kPa (a 25°C) |
| Densità del vapore | 2,48 (aria = 1) |
| pKa | N / A |
| pH | Neutro |
Sicurezza e pericoli dell’isobutilene
L’isobutene comporta diversi rischi per la sicurezza. È altamente infiammabile, il che significa che può accendersi facilmente se esposto a una fonte di accensione. Pertanto è necessario adottare le opportune precauzioni per evitare incendi ed esplosioni. I vapori di isobutene sono più pesanti dell’aria e possono accumularsi in aree basse, aumentando il rischio di incendio. Il contatto diretto con isobutene può causare irritazione alla pelle e agli occhi. L’inalazione di elevate concentrazioni può causare problemi respiratori, vertigini e persino asfissia. Quando si maneggia l’isobutene è necessario utilizzare una ventilazione adeguata e dispositivi di protezione individuale per ridurre al minimo il rischio di esposizione. È essenziale seguire adeguati protocolli di sicurezza e maneggiare questa sostanza con cautela.
| Simboli di pericolo | Gas infiammabile |
| Descrizione della sicurezza | Tenere lontano da fonti di ignizione. |
| Utilizzare in un’area ben ventilata. | |
| Indossare indumenti e occhiali protettivi. | |
| Identificatori delle Nazioni Unite | ONU 1075 |
| Codice SA | 2901.11.00 |
| Classe di pericolo | 2.1 (Gas infiammabile) |
| Gruppo di imballaggio | GE II |
| Tossicità | Tossicità acuta per inalazione, nocivo se ingerito o a contatto con pelle/occhi. |
Metodi per la sintesi dell’isobutilene
Esistono diversi metodi per sintetizzare l’isobutene.
Un metodo comune prevede la deidrogenazione catalitica dell’isobutano, in cui l’isobutano passa su un catalizzatore, solitamente un ossido metallico o un catalizzatore metallico supportato, a temperature elevate. Il catalizzatore facilita la rimozione dell’idrogeno dall’isobutano, con conseguente formazione di isobutene.
Un altro metodo prevede il cracking termico delle frazioni petrolifere ricche di idrocarburi ramificati, come i buteni, mediante l’applicazione di temperature elevate. La reazione di cracking rompe le molecole di idrocarburi più grandi in molecole più piccole, producendo isobutene.
Quando si effettua lo steam cracking degli idrocarburi, il processo produce isobutene come sottoprodotto. Lo steam cracking comporta il sottoporre idrocarburi, come l’etano o la nafta, ad alte temperature in presenza di vapore, ottenendo una miscela di olefine, compreso l’isobutene.
Inoltre, la sintesi dell’isobutene prevede l’esecuzione di una reazione di metatesi tra etilene e 2-butene . Le reazioni di metatesi comportano lo scambio di gruppi funzionali o sostituenti tra molecole reagenti. Sottoponendo l’etilene e il 2-butene a condizioni di metatesi, è possibile produrre isobutene.
Questi metodi di sintesi offrono diversi approcci per ottenere isobutene, soddisfacendo diversi requisiti industriali e disponibilità di materie prime. Ciascun metodo presenta vantaggi e considerazioni in termini di condizioni di reazione, selezione del catalizzatore e resa di ottimizzazione.
Usi dell’isobutilene
L’isobutene svolge un ruolo cruciale in un’ampia gamma di applicazioni grazie alle sue proprietà uniche. Alcuni usi comuni dell’isobutene includono:
- L’isobutene è una materia prima chiave nella produzione della gomma butilica, che i produttori utilizzano per creare camere d’aria per pneumatici, tubi flessibili per automobili, guarnizioni e guarnizioni, grazie alla sua eccellente resistenza al calore, agli agenti chimici e alla sua impermeabilità ai gas.
- Le industrie utilizzano l’isobutene come additivo per carburanti per migliorare il numero di ottano della benzina, migliorando così l’efficienza della combustione e riducendo la detonazione per migliori prestazioni del carburante.
- L’isobutene subisce polimerizzazione per produrre poliisobutene (PIB), un polimero versatile ampiamente utilizzato in varie applicazioni industriali come lubrificanti, adesivi, sigillanti e come agente addensante.
- I produttori utilizzano l’isobutene come precursore nella produzione di alcol isobutilico, un solvente ampiamente utilizzato in rivestimenti, resine e prodotti per la cura personale.
- L’isobutene funge da elemento costitutivo per la sintesi di varie sostanze chimiche, inclusi antiossidanti, plastificanti, aromi, fragranze e prodotti farmaceutici, dimostrando il suo ruolo di prezioso intermedio chimico.
- Le industrie aggiungono isobutene al gas di petrolio liquefatto (GPL) come componente di miscelazione per migliorarne la qualità e la stabilità, garantendo un utilizzo sicuro ed efficiente.
- Trova applicazione come componente nelle miscele refrigeranti utilizzate negli impianti di refrigerazione e condizionamento.
- Le industrie si affidano agli adesivi all’isobutene per le loro forti proprietà di adesione e li utilizzano nei settori dell’edilizia, automobilistico e dell’imballaggio.
- L’isobutene viene utilizzato come estraente nella produzione di vari prodotti chimici, inclusi prodotti farmaceutici e aromi.
- Agisce come propellente nei prodotti aerosol come spray, schiume e deodoranti.
Queste applicazioni dimostrano l’importanza dell’isobutene in vari settori e il suo contributo a molti prodotti di uso quotidiano.
Domande:
D: Quanto pesa un litro di isobutilene?
R: Un gallone di isobutene pesa circa 4,88 libbre (libbre).
D: Cos’è l’isobutilene?
R: L’isobutene è un gas incolore utilizzato nella produzione di carburanti, prodotti chimici e gomma sintetica.
D: L’isobutilene contiene isomeri cis o trans?
R: L’isobutene non ha isomeri cis o trans perché è un idrocarburo ramificato.
D: L’isobutilene ha un gruppo vinilico?
R: Sì, l’isobutilene contiene un gruppo vinilico, più specificamente un doppio legame tra due atomi di carbonio.
D: L’isobutilene è presente in RP1?
R: No, l’isobutene non è un componente dell’RP-1 (Rocket Propellant-1), che è una forma altamente raffinata di cherosene.
D: Perché l’isobutilene (-7°C) ha un punto di ebollizione inferiore rispetto all’acetone (56°C)?
R: L’isobutene ha un punto di ebollizione inferiore all’acetone a causa del suo peso molecolare inferiore e delle forze intermolecolari più deboli.
D: Quale dei seguenti composti è adatto a promuovere la polimerizzazione cationica dell’isobutilene?
R: Gli acidi di Lewis come il trifluoruro di boro (BF3) o il cloruro di alluminio (AlCl3) possono essere utilizzati per promuovere la polimerizzazione cationica dell’isobutilene.
D: Come viene conservato l’isobutilene?
R: L’isobutene viene solitamente conservato in contenitori o bombole sotto pressione per mantenerlo allo stato gassoso.
D: Quale(i) bromuro(i) organico(i) subirebbe la deidroalogenazione E2 per produrre isobutilene come alchene puro?
R: Il 2-bromobutano (sec-butil bromuro) o il tert-butil bromuro possono subire la deidroalogenazione E2 per produrre isobutilene come alchene puro.
