L’ipoclorito di magnesio (Mg(ClO)2) è un composto chimico composto da magnesio, ossigeno e cloro. Viene utilizzato come disinfettante, candeggina e prodotto chimico per il trattamento dell’acqua.
| Nome dell’IUPAC | Ipoclorito di magnesio |
| Formula molecolare | Mg(ClO)2 |
| numero CAS | 10233-03-1 |
| Sinonimi | Clorato di magnesio, sale di magnesio dell’acido ipocloroso, ossicloruro di magnesio, MagOCl |
| InChI | InChI=1S/Cl2O2.Mg/c1-3-2;/q-1;+2 |
Proprietà dell’ipoclorito di magnesio
Formula di ipoclorito di magnesio
L’ipoclorito di magnesio ha una formula chimica di Mg(ClO)2, il che significa che contiene un atomo di magnesio, due atomi di cloro e due atomi di ossigeno per molecola. È un solido bianco con un leggero odore di cloro ed è comunemente usato come disinfettante e prodotto chimico per il trattamento dell’acqua.
Massa molare dell’ipoclorito di magnesio
La massa molare di Mg(ClO)2 è 127,21 g/mol. Questo valore si calcola sommando le masse atomiche di ciascun elemento nella formula chimica, ovvero magnesio (24,31 g/mol), cloro (35,45 g/mol) e ossigeno (15,99 g/mol). mol), moltiplicati per i rispettivi indici.
Punto di ebollizione dell’ipoclorito di magnesio
Mg(ClO)2 non ha un punto di ebollizione definito perché si decompone prima di raggiungere il punto di ebollizione. Quando riscaldato, Mg(ClO)2 rilascia ossigeno gassoso, lasciando dietro di sé il cloruro di magnesio come residuo solido.
Ipoclorito di magnesio Punto di fusione
Il punto di fusione di Mg(ClO)2 è 100°C. A questa temperatura, i cristalli solidi di Mg(ClO)2 si trasformano in un liquido. Tuttavia, a causa della sua instabilità alle alte temperature, si consiglia di maneggiarlo con cura.
Densità dell’ipoclorito di magnesio g/mL
La densità di Mg(ClO)2 è 2,08 g/mL a temperatura ambiente. Ciò significa che un millilitro di Mg(ClO)2 ha una massa di 2,08 grammi.
Peso Molecolare dell’Ipoclorito di Magnesio
Il peso molecolare di Mg(ClO)2 è 127,21 g/mol. È la somma dei pesi atomici di tutti gli elementi del composto, ovvero magnesio, cloro e ossigeno.
Struttura dell’ipoclorito di magnesio
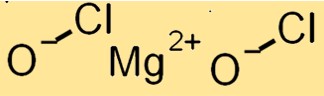
Mg(ClO)2 ha una struttura cristallina con un sistema cristallino monoclino. È costituito da cationi Mg+2 e anioni ClO, tenuti insieme da legami ionici. Gli anioni ClO si trovano in una disposizione tetraedrica distorta attorno ai cationi Mg+2.
Solubilità dell’ipoclorito di magnesio
Mg(ClO)2 è leggermente solubile in acqua, con una solubilità di 14,6 g/100 mL a 20°C. Forma una soluzione leggermente basica in acqua per idrolisi degli ioni ipoclorito. Tuttavia, non è consigliabile sciogliere Mg(ClO)2 in acqua poiché ciò può produrre gas di cloro, che è tossico e può essere dannoso per la salute umana.
| Aspetto | Solido bianco |
| Peso specifico | 2,08 g/ml a 20°C |
| Colore | Bianco |
| Odore | Leggermente clorato |
| Massa molare | 127,21 g/mole |
| Densità | 2,08 g/ml a 20°C |
| Punto di fusione | 100°C |
| Punto di ebollizione | Si decompone prima di raggiungere il punto di ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Leggermente solubile (14,6 g/100 mL a 20°C) |
| Solubilità | Leggermente solubile in acqua, solubile negli acidi |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Soluzione un po’ basica |
Sicurezza e pericoli dell’ipoclorito di magnesio
Il Mg(ClO)2 può essere pericoloso se non maneggiato correttamente. È un forte agente ossidante che può reagire violentemente con alcune sostanze chimiche. Il contatto con la pelle, gli occhi e le mucose può causare irritazioni e ustioni. L’inalazione di polvere o nebbia può causare problemi respiratori. È anche importante evitare di mescolare Mg(ClO)2 con acidi o altri composti contenenti cloro, poiché ciò può produrre gas di cloro tossico. Si consiglia di indossare dispositivi di protezione come guanti e occhiali protettivi durante la manipolazione di Mg(ClO)2 e di conservarlo in un luogo fresco e asciutto, lontano da sostanze chimiche incompatibili.
| Simboli di pericolo | Agente ossidante, nocivo |
| Descrizione della sicurezza | Tenere lontano da fonti di calore, scintille e fiamme libere. Non respirare la polvere o la nebbia. Indossare guanti e occhiali protettivi. |
| Numeri di identificazione delle Nazioni Unite | Un 1748 |
| Codice SA | 2828.10.10 |
| Classe di pericolo | 5.1 (Agente ossidante), 6.1 (Tossico) |
| Gruppo di imballaggio | II |
| Tossicità | LD50 (orale, ratto) – 290 mg/kg; LC50 (inalazione, ratto) – 2,07 mg/L/4 ore; Irritazione cutanea – Lieve; Irritazione degli occhi – Grave |
Metodi di sintesi dell’ipoclorito di magnesio
Per sintetizzare Mg(ClO)2, il metodo più comunemente utilizzato è quello di far reagire l’ossido di magnesio con il cloro gassoso.
In un metodo, per produrre Mg(ClO)2, l’ossido di magnesio deve essere miscelato con cloro gassoso in presenza di acqua. È necessario un attento controllo durante la reazione esotermica per evitare la formazione di sottoprodotti indesiderati.
Un altro metodo prevede la reazione tra idrossido di magnesio e acido ipocloroso. Per mantenere il pH, la reazione avviene solitamente in una soluzione di idrossido di sodio. La soluzione risultante di Mg(ClO)2 può essere separata mediante filtrazione e quindi essiccata dopo la reazione.
Un terzo metodo prevede la reazione tra carbonato di magnesio e acido ipocloroso. Questa reazione produce Mg(ClO)2 e anidride carbonica. Per evitare la formazione di sottoprodotti indesiderati è necessario monitorare attentamente la reazione.
Indipendentemente dal metodo di sintesi utilizzato, è importante maneggiare Mg(ClO)2 con cura a causa delle sue proprietà ossidanti e dei potenziali pericoli.
Usi dell’ipoclorito di magnesio
Mg(ClO)2 ha diverse applicazioni pratiche grazie alle sue proprietà ossidanti e alla sua capacità di rilasciare cloro gassoso. Ecco alcuni usi comuni di Mg(ClO)2:
- Trattamento dell’acqua: comunemente usato come disinfettante negli impianti di trattamento dell’acqua per uccidere batteri e virus nocivi.
- Candeggina: utilizzata come agente sbiancante per tessuti, carta e altri materiali.
- Piscine: utilizzato come agente disinfettante nelle piscine per mantenere una buona chimica dell’acqua.
- Controllo degli odori: utilizzato per controllare gli odori sgradevoli negli impianti di trattamento dei rifiuti e nei sistemi fognari.
- Agente ossidante: utilizzato come agente ossidante nella produzione di vari prodotti chimici, come epossidi e chetoni.
- Agricoltura: utilizzato in agricoltura come disinfettante e pesticida per combattere malattie fungine e batteriche.
- Servizi igienico-sanitari: utilizzato anche come disinfettante per superfici e attrezzature negli ospedali, negli impianti di lavorazione alimentare e in altre strutture.
Domande:
D: Qual è la formula dell’ipoclorito di magnesio?
R: La formula dell’ipoclorito di magnesio è Mg(ClO)2.
D: Qual è il livello di pH dell’ipoclorito di magnesio?
R: Il livello di pH di Mg(ClO)2 dipende dalla sua concentrazione e può variare. Tuttavia, una soluzione di Mg(ClO)2 ha generalmente un pH compreso tra 8 e 10.
D: Qual è la formula molecolare dell’ipoclorito di magnesio?
R: La formula molecolare dell’ipoclorito di magnesio è Mg(ClO)2.
D: Qual è il nome di Mg(ClO)2?
R: Il nome di Mg(ClO)2 è ipoclorito di magnesio.
D: Mg(ClO)2 è un acido o una base?
R: Mg(ClO)2 è un sale basico e può agire come base debole nelle soluzioni acquose.
D: Mg(ClO)2 è un sale?
R: Sì, Mg(ClO)2 è sale. È un composto cristallino bianco altamente solubile in acqua e contiene sia un metallo (magnesio) che un non metallo (cloro).
