L’ipoclorito di calcio (Ca(ClO)2) è un composto chimico comunemente usato come disinfettante e candeggina. È efficace nell’uccidere batteri, virus e alghe nel trattamento dell’acqua e nei servizi igienico-sanitari.
| Nome IUPAC | Ipoclorito di calcio |
| Formula molecolare | Ca(ClO)2 |
| numero CAS | 7778-54-3 |
| Sinonimi | Sale di calcio dell’acido ipocloroso, Polvere decolorante, Calce clorata, Ossicloruro di calcio, HTH, Cal ipo |
| InChI | InChI=1S/Ca.2ClO/c;2 1-2/q+2;2 -1 |
Proprietà dell’ipoclorito di calcio
Formula dell’ipoclorito di calcio
L’ipoclorito di calcio ha la formula chimica Ca(ClO)2. È un solido cristallino bianco che emana un forte odore di cloro. La formula dell’ipoclorito di calcio mostra che contiene uno ione Ca+2 e due ioni ClO-. Lo ione ipoclorito ha carica negativa ed è responsabile delle forti proprietà ossidanti del composto.
Massa molare dell’ipoclorito di calcio
La massa molare di Ca(ClO)2 è 142,98 g/mol. Si calcola sommando le masse atomiche di calcio, cloro e ossigeno presenti in una molecola di Ca(ClO)2. La massa molare di Ca(ClO)2 è un parametro importante utilizzato in vari calcoli chimici.
Punto di ebollizione dell’ipoclorito di calcio
Ca(ClO)2 si decompone prima di raggiungere il punto di ebollizione. Il suo punto di ebollizione non è quindi ben definito. Quando il Ca(ClO)2 viene riscaldato, subisce una decomposizione termica per formare cloruro di calcio, ossigeno e cloro gassoso.
Ipoclorito di calcio Punto di fusione
Il punto di fusione di Ca(ClO)2 è 100°C. A questa temperatura, Ca(ClO)2 si scioglie per formare un liquido limpido. Ca(ClO)2 è molto solubile in acqua e quando si dissolve in acqua rilascia ioni ipoclorito, rendendolo un disinfettante efficace.
Densità dell’ipoclorito di calcio g/mL
La densità di Ca(ClO)2 è 2,35 g/mL. È un composto relativamente denso e più pesante dell’acqua. L’elevata densità di Ca(ClO)2 è dovuta alla presenza di ioni calcio nel suo reticolo cristallino.
Peso Molecolare dell’Ipoclorito di Calcio
Il peso molecolare di Ca(ClO)2 è 142,98 g/mol. Si calcola sommando le masse atomiche di calcio, cloro e ossigeno presenti in una molecola di Ca(ClO)2. Il peso molecolare di Ca(ClO)2 è un parametro importante utilizzato in vari calcoli chimici.
Struttura dell’ipoclorito di calcio
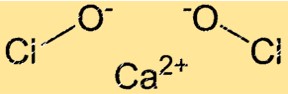
Ca(ClO)2 ha una struttura cristallina. Il reticolo cristallino Ca(ClO)2 è composto da ioni Ca+2 e ioni ClO-. Gli ioni ClO- sono disposti in una geometria tetraedrica attorno agli ioni Ca+2. La struttura reticolare cristallina di Ca(ClO)2 gli conferisce le sue forti proprietà ossidanti.
Solubilità dell’ipoclorito di calcio
Ca(ClO)2 è molto solubile in acqua. Si dissolve in acqua per formare uno ione ipoclorito e uno ione calcio. La solubilità di Ca(ClO)2 in acqua aumenta con l’aumentare della temperatura. Ca(ClO)2 è solubile anche in solventi organici come acetone ed etanolo.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2.35 |
| Colore | Bianco |
| Odore | Odore di cloro |
| Massa molare | 142,98 g/mole |
| Densità | 2,35 g/cm³ |
| Punto di fusione | 100°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | 21 g/100 ml (20°C) |
| Solubilità | Solubile in acetone, etanolo, glicerolo e acqua |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 7.5 |
| pH | ~11 |
Sicurezza e pericoli dell’ipoclorito di calcio
Ca(ClO)2 può essere pericoloso se non maneggiato correttamente. È un potente ossidante che può reagire violentemente con i composti organici, liberando gas tossici. Può causare irritazione alla pelle e agli occhi e l’esposizione prolungata può portare a problemi respiratori. Dovrebbe essere conservato in un luogo fresco, asciutto e ben ventilato, lontano da sostanze organiche, agenti riducenti e acidi. Il Ca(ClO)2 deve essere maneggiato con cura e durante la manipolazione devono essere indossati dispositivi di protezione, come guanti e occhiali. Non deve essere miscelato con altri prodotti chimici, inclusi acidi o agenti riducenti, poiché ciò potrebbe causare un’esplosione.
| Simboli di pericolo | O, Xi, N |
| Descrizione della sicurezza | Nocivo se ingerito, provoca irritazione alla pelle, provoca grave irritazione agli occhi, può provocare il cancro |
| Numeri di identificazione delle Nazioni Unite | ONU1748 |
| Codice SA | 2828.90.00 |
| Classe di pericolo | 5.1 (Agenti ossidanti) |
| Gruppo di imballaggio | II |
| Tossicità | LD50 (orale, ratto) = 850 mg/kg; LC50 (inalazione, ratto) = 10,8 mg/m³ (esposizione di 4 ore) |
Metodi per la sintesi dell’ipoclorito di calcio
Esistono diversi metodi per sintetizzare Ca(ClO)2.
Un metodo prevede la miscelazione di cloro gassoso con calce spenta, nota anche come idrossido di calcio , in acqua. La reazione produce Ca(ClO)2, cloruro di calcio e acqua. Un altro metodo prevede la reazione del cloro gassoso con l’idrossido di calcio secco, ottenendo Ca(ClO)2 e vapore acqueo.
Il processo di produzione su larga scala di Ca(ClO)2 prevede tipicamente la reazione dell’ipoclorito di sodio con cloruro di calcio , che genera Ca(ClO)2 e cloruro di sodio.
Un altro metodo prevede la reazione del carbonato di calcio con il cloro gassoso in presenza di acqua o acido acetico. La reazione produce Ca(ClO)2, anidride carbonica, acqua o acetato di calcio e acido cloridrico.
Questi metodi richiedono un’attenta manipolazione e attrezzature adeguate per garantire sicurezza ed efficacia. La scelta del metodo dipende dalla scala di produzione e dalla purezza desiderata del prodotto finale.
Usi dell’ipoclorito di calcio
Ca(ClO)2 ha una vasta gamma di usi grazie alle sue forti proprietà ossidanti e disinfettanti. Ecco alcuni usi comuni di Ca(ClO)2:
- Trattamento dell’acqua: ampiamente utilizzato per disinfettare l’acqua nelle piscine, nei sistemi di acqua potabile e negli impianti di trattamento delle acque reflue.
- Candeggina: utilizzata come agente sbiancante per cotone, lino e pasta di carta, nonché nella produzione di carta e tessuti.
- Disinfezione: comunemente utilizzato per disinfettare superfici e attrezzature nell’industria alimentare.
- Deodorizzazione: Utilizzato per rimuovere gli odori sgradevoli da tessuti, tappeti e altri materiali.
- Disinfettante: disinfettante efficace per ospedali, laboratori e altre strutture sanitarie.
- Controllo delle alghe: utilizzato per controllare la crescita delle alghe nei corpi idrici, come stagni e laghi.
- Sintesi chimica: utilizzato nella sintesi di vari composti organici e inorganici.
- Uso domestico: utilizzato come disinfettante domestico, in particolare per pulire e disinfettare servizi igienici e tubazioni.
- Perforazione di pozzi petroliferi: utilizzata anche nella perforazione di pozzi petroliferi per prevenire la crescita di batteri e altri microrganismi.
Domande:
D: Puoi usare l’ipoclorito di calcio per rimuovere un tatuaggio?
R: No, Ca(ClO)2 non deve essere utilizzato per rimuovere un tatuaggio. È un forte agente ossidante che può causare gravi danni alla pelle e cicatrici.
D: Come conservo l’ipoclorito di calcio?
R: Ca(ClO)2 deve essere conservato in un’area fresca, asciutta e ben ventilata, lontano dalla luce solare diretta, da fonti di calore e da sostanze incompatibili. Deve essere conservato in un contenitore ben chiuso e protetto dall’umidità e dall’acqua.
D: Dove acquistare l’ipoclorito di calcio?
R: Il Ca(ClO)2 può essere acquistato presso aziende di fornitura di prodotti chimici, negozi di forniture per piscine e rivenditori online.
D: Quanto ipoclorito di calcio per l’acqua potabile?
R: La quantità di Ca(ClO)2 richiesta per il trattamento dell’acqua potabile dipende dalla concentrazione della soluzione e dal volume di acqua da trattare. Il dosaggio consigliato è generalmente compreso tra 0,2 e 0,5 ppm (parti per milione) per una disinfezione regolare.
D: Quanto ipoclorito di calcio è sicuro da ingerire?
R: Il Ca(ClO)2 non dovrebbe mai essere ingerito, poiché è altamente tossico e può causare seri problemi di salute o addirittura la morte.
D: Purificazione dell’acqua con ipoclorito di calcio?
R: Il Ca(ClO)2 è comunemente utilizzato per la purificazione e la disinfezione dell’acqua in una varietà di ambienti, tra cui piscine, sistemi di acqua potabile e impianti di trattamento delle acque reflue.
D: Shock con ipoclorito di calcio?
R: Lo shock Ca(ClO)2 è un processo di aggiunta di una concentrazione maggiore di Ca(ClO)2 a una piscina o spa per aumentare rapidamente i livelli di cloro ed eliminare batteri e contaminanti nocivi.
D: Ipoclorito di calcio per disinfettare l’acqua?
R: Ca(ClO)2 è un potente disinfettante spesso utilizzato per il trattamento e la purificazione dell’acqua per eliminare batteri, virus e altri microrganismi dannosi.
D: Ca(OCl)2 è un acido o una base?
R: L’ipoclorito di calcio (Ca(OCl)2) è una base perché può accettare un protone per formare uno ione idrossido.
D: Quale forma ridotta di Ca(OCl)2 rimane alla fine dell’esperimento?
R: La forma ridotta di Ca(OCl)2 che rimane alla fine di un esperimento dipende dalla specifica reazione che avviene. In alcuni casi può essere cloruro di calcio (CaCl2) o carbonato di calcio (CaCO3).
