Lo ione carbonato, CO32-, è uno ione caricato negativamente composto da un atomo di carbonio, tre atomi di ossigeno e una carica complessiva di -2. Si trova comunemente in minerali come calcite e dolomite, nonché in soluzioni acquose come il bicarbonato. Svolge un ruolo cruciale nel controllo dei livelli di pH nell’oceano e in altri corpi idrici.
| Nome IUPAC | Ione carbonato |
| Formula molecolare | CO32- |
| numero CAS | 497-19-8 |
| Sinonimi | Acido carbonico, Triossido di carbonio |
| InChI | InChI=1S/CH2O3.2K/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Proprietà degli ioni carbonato
Formula di carbonato
La formula per lo ione carbonato è rappresentata da CO3^2-, dove C rappresenta il carbonio, O rappresenta l’ossigeno e il simbolo 2- rappresenta la carica negativa dello ione. Questa formula indica che ci sono tre atomi di ossigeno e un atomo di carbonio nello ione carbonato, conferendogli la sua caratteristica struttura molecolare.
Carica di carbonato di CO3
Lo ione carbonato, CO3^2-, ha una carica negativa 2 dovuta alla presenza di tre atomi di ossigeno e un atomo di carbonio nella sua formula chimica. La carica negativa risulta dalla presenza di elettroni extra nello ione carbonato, rendendolo uno ione carico negativamente.
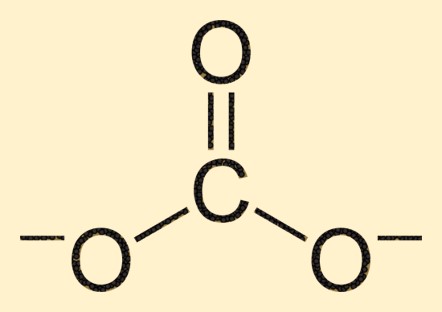
Struttura carbonatica
Lo ione carbonato è composto da un atomo di carbonio al centro, circondato da tre atomi di ossigeno in una disposizione planare trigonale. L’atomo di carbonio forma un doppio legame con un atomo di ossigeno, mentre gli altri due atomi di ossigeno sono legati all’atomo di carbonio tramite legami singoli. Questa struttura conferisce allo ione CO3 2- la sua forma e proprietà caratteristiche.
Peso molecolare dello ione carbonato
Il peso molecolare dello ione carbonato è di circa 60,01 g/mol, calcolato in base ai pesi atomici dei suoi elementi costitutivi (carbonio, ossigeno). Il peso molecolare dell’acido carbonico è importante per determinare la quantità di acido carbonico in un campione, nonché per determinarne le proprietà fisiche e chimiche.
| Aspetto | Polvere bianca solida |
| Peso specifico | 2.5 |
| Colore | Bianco |
| Odore | Nessuno |
| Massa molare | 100,09 g/mole |
| Densità | 2,83 g/cm3 |
| Punto di fusione | 825°C |
| Punto di ebollizione | 1484°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile in acqua |
| Solubilità | Solubile negli acidi |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| PKa | 10:33 |
| PH | 8.6 |
Sicurezza e pericoli degli ioni carbonato
Lo ione carbonato, CO32-, è ampiamente utilizzato in vari settori, ma deve essere maneggiato con cautela. L’inalazione di elevati livelli di polvere di carbonato può causare problemi respiratori, mentre l’ingestione di grandi quantità può causare problemi digestivi. Il contatto con la pelle può provocare irritazioni e lesioni cutanee. È anche infiammabile e può reagire con altri prodotti chimici producendo gas pericolosi. È importante seguire le misure di sicurezza, come indossare dispositivi di protezione individuale e conservare gli ioni carbonato in contenitori adeguati, per ridurre al minimo il rischio di incidenti.
| Simbolo di pericolo | Nessuno |
| Descrizione della sicurezza | Non è considerato pericoloso e non è associato ad alcun simbolo di pericolo specifico. |
| UN ID | N / A |
| Codice SA | N / A |
| Classe di pericolo | N / A |
| Gruppo di imballaggio | N / A |
| Tossicità | Non tossico |
Metodi di sintesi degli ioni carbonato
Gli ioni carbonato (CO3 2- ) possono essere sintetizzati con una varietà di metodi diversi. Il metodo più comune per produrre ioni CO3 2- è quello di far reagire anidride carbonica e acqua. Questa reazione produce una soluzione di acido carbonico, che può quindi essere neutralizzata con un alcali, come l’idrossido di sodio, per produrre acido carbonico. L’acido carbonico può anche essere prodotto mediante elettrolisi di una soluzione salina, dove si formano ioni carbonato al catodo. Questi ioni possono anche essere prodotti in laboratorio mediante una reazione chimica tra un acido e un sale carbonato.
Usi degli ioni carbonato
Le industrie utilizzano ampiamente l’acido carbonico per vari scopi. I produttori di lievito in polvere, i produttori di antiacidi e le aziende produttrici di bevande incorporano comunemente l’acido carbonico nei loro prodotti. L’industria del trattamento dell’acqua controlla i livelli di pH nell’acqua potabile e nelle piscine utilizzando ioni carbonato. L’industria delle costruzioni utilizza gli ioni CO3 2- come componente principale del cemento per produrre calcestruzzo. Gli agricoltori aggiungono ioni carbonato al terreno per migliorarne l’alcalinità e promuovere la crescita delle colture. L’industria chimica utilizza gli ioni carbonato come catalizzatore e reagente in varie reazioni chimiche. L’industria alimentare conserva il cibo incorporando ioni carbonato. Grazie alla loro versatilità, gli ioni carbonato svolgono un ruolo essenziale in molti prodotti di uso quotidiano e processi industriali.
