Cos’è l’ammonio NH4+?
Lo ione ammonio (NH4+) è uno ione poliatomico carico positivamente costituito da un atomo di azoto e quattro atomi di idrogeno. Si trova comunemente nei fertilizzanti e nei composti organici.
| Nome IUPAC | Azanio |
| Formula molecolare | NH4+ |
| numero CAS | 14798-03-9 |
| Sinonimi | Catione di ammonio, tetraidronitrogeno (1+), amminonio, azanio, catione di idruro di azoto, idronitrogeno, ione di azoto |
| InChI | InChI=1S/H3N/h1H3/p+1 |
Nota: InChI riguarda lo ione ammonio nella sua forma più semplice, con un singolo idrogeno ionizzato. L’InChI effettivo può variare a seconda dell’ambiente chimico dello ione ammonio.
Formula dell’ammonio
La formula dello ione ammonio è NH4+. È un catione poliatomico composto da un atomo di azoto e quattro atomi di idrogeno. Lo ione ammonio si forma dalla protonazione dell’ammoniaca (NH3) con uno ione idrogeno (H+). Lo ione ammonio è un catione comune nei composti inorganici e organici, inclusi fertilizzanti, prodotti farmaceutici ed esplosivi.
Catione ammonio
Il catione ammonio, noto anche come NH4+, è uno ione poliatomico carico positivamente composto da un atomo di azoto e quattro atomi di idrogeno. Si forma quando l’ammoniaca (NH3) accetta un protone (H+) da un acido, dando luogo alla formazione di sale di ammonio.
Massa molare degli ioni ammonio
La massa molare dello ione ammonio (NH4+) è 18,04 g/mol. Questo valore viene calcolato sommando le masse atomiche di un atomo di azoto (14,01 g/mol) e quattro atomi di idrogeno (1,01 g/mol ciascuno). La massa molare è una proprietà importante dello ione ammonio perché consente la conversione della sua massa in moli e viceversa. Ciò è utile in molti calcoli chimici, come determinare la quantità di reagenti necessari per una reazione chimica.
Punto di ebollizione degli ioni ammonio
Poiché lo ione ammonio si trova solitamente in un sale, come il cloruro di ammonio (NH4Cl), non ha un proprio punto di ebollizione. Invece, il punto di ebollizione del cloruro di ammonio, che è 520 °C, è influenzato da vari fattori come la forza del legame ionico tra lo ione ammonio e lo ione cloruro, nonché la dimensione e la forma dello ione ammonio.
Punto di fusione degli ioni ammonio
Similmente al punto di ebollizione, lo ione ammonio non ha un punto di fusione perché non è una sostanza che esiste in forma pura. Tuttavia, i sali contenenti lo ione ammonio, come il nitrato di ammonio (NH4NO3), hanno un punto di fusione di 169,6°C. Il punto di fusione del nitrato di ammonio è influenzato dalla forza del legame ionico tra lo ione ammonio e lo ione nitrato, nonché dalla struttura cristallina del composto.
Densità degli ioni ammonio g/ml
La densità dello ione ammonio (NH4+) non è applicabile perché è uno ione poliatomico e non esiste come entità separata. Tuttavia, i sali contenenti lo ione ammonio, come il solfato di ammonio (NH4)2SO4, hanno una densità di 1,77 g/cm³ a temperatura ambiente. La densità dei sali contenenti lo ione ammonio è influenzata da vari fattori, tra cui la dimensione e la forma degli ioni, la forza del legame ionico e la struttura cristallina del composto.
Peso molecolare degli ioni ammonio
Il peso molecolare dello ione ammonio (NH4+) è 18,04 g/mol, calcolato sommando le masse atomiche di un atomo di azoto e quattro atomi di idrogeno. Il peso molecolare è una proprietà importante dello ione ammonio perché consente la conversione della sua massa in moli e viceversa. Ciò è utile in molti calcoli chimici, come determinare la quantità di reagenti necessari per una reazione chimica.
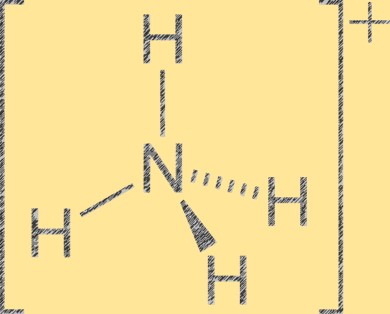
Struttura degli ioni ammonio
Lo ione ammonio (NH4+) ha una geometria molecolare tetraedrica con un atomo di azoto al centro e quattro atomi di idrogeno agli angoli del tetraedro. L’atomo di azoto ha una carica formale positiva pari a +1, mentre ciascun atomo di idrogeno ha una carica formale pari a -1. Lo ione ammonio è un catione poliatomico formato dalla protonazione dell’ammoniaca (NH3) con uno ione idrogeno (H+). Lo ione ammonio è un catione comune nei composti inorganici e organici, inclusi fertilizzanti, prodotti farmaceutici ed esplosivi.
| Aspetto | Gas solido cristallino bianco o incolore |
| Peso specifico | Non applicabile (ione poliatomico) |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 18,04 g/mole |
| Densità | Non applicabile (ione poliatomico), la densità del sale varia (ad es. 1,77 g/cm³ per solfato di ammonio) |
| Punto di fusione | Non applicabile (ione poliatomico), il punto di fusione dei sali varia (ad es. 169,6°C per il nitrato di ammonio) |
| Punto di ebollizione | Non applicabile (ione poliatomico), il punto di ebollizione dei sali varia (ad es. 520 °C per il cloruro di ammonio) |
| Punto flash | Non applicabile (ione poliatomico) |
| solubilità in acqua | Molto solubile (completamente miscibile) in acqua |
| Solubilità | Solubile in alcoli e ammoniaca liquida |
| Pressione del vapore | Non applicabile (ione poliatomico) |
| Densità del vapore | Non applicabile (ione poliatomico) |
| pKa | 9.25 (acido coniugato, catione ammonio) |
| pH | 7 (neutro) in soluzione acquosa |
Nota: i valori presentati nella tabella possono variare a seconda della forma chimica e delle condizioni specifiche dello ione ammonio.
Sicurezza e pericoli degli ioni ammonio
Lo ione ammonio, nella sua forma pura, è generalmente considerato sicuro e non tossico. Tuttavia, come molti composti chimici, lo ione ammonio può comportare alcuni pericoli e rischi, in particolare se maneggiato o utilizzato in modo inappropriato. Lo ione ammonio può rilasciare gas tossico di ammoniaca quando reagisce con basi forti o acidi forti. Potrebbe anche comportare pericolo di incendio ed esplosione se esposto a calore o fiamme. Inoltre, l’esposizione ad alte concentrazioni di ioni ammonio o suoi derivati può causare irritazione agli occhi, alla pelle e al sistema respiratorio. È importante seguire protocolli di sicurezza adeguati e maneggiare lo ione ammonio e i suoi derivati con cura per evitare potenziali pericoli.
| Simboli di pericolo | Nessuno assegnato per lo ione ammonio puro |
| Descrizione della sicurezza | Nocivo se ingerito, inalato o assorbito attraverso la pelle. Provoca irritazione alla pelle, agli occhi e alle vie respiratorie. Può rilasciare gas di ammoniaca tossico. Può presentare pericolo di incendio ed esplosione. |
| UN ID | 3077 (per composti di ammonio, compresi i sali di ammonio) |
| Codice SA | 2827.10.00 (per cloruro di ammonio, carbonato di ammonio e altri sali di ammonio) |
| Classe di pericolo | 9 (Sostanze e oggetti pericolosi vari) per composti di ammonio, Classe 8 (Materie corrosive) per soluzione di idrossido di ammonio |
| Gruppo di imballaggio | III (per composti di ammonio) |
| Tossicità | Generalmente considerato non tossico nella sua forma pura, ma può rilasciare gas di ammoniaca tossico. I composti e i derivati dell’ammonio possono essere tossici o dannosi per la salute umana e l’ambiente a seconda delle loro proprietà e del loro utilizzo specifici. |
Metodi per la sintesi degli ioni ammonio
Lo ione ammonio può essere sintetizzato utilizzando una varietà di metodi, comprese reazioni chimiche e processi biologici.
Un metodo comune per sintetizzare lo ione ammonio consiste nel far reagire il gas di ammoniaca con un acido, come acido cloridrico o acido solforico, per produrre sale di ammonio. La reazione comporta lo spostamento degli ioni idrogeno (H+) nell’acido da parte delle molecole di ammoniaca, con conseguente formazione del catione ammonio (NH4+) e del corrispondente anione dell’acido (es. cloruro, solfato). Il sale di ammonio risultante può essere purificato e cristallizzato per ottenere uno ione ammonio.
Anche i processi biologici, come la decomposizione della materia organica da parte dei microbi, possono provocare la formazione di ioni ammonio. Durante questo processo, i composti contenenti azoto vengono scomposti da batteri e altri microrganismi, producendo ammoniaca ed eventualmente ioni ammonio. Questo processo è noto come ammonificazione ed è un passaggio importante nel ciclo dell’azoto.
Un altro metodo per sintetizzare lo ione ammonio utilizza il processo Haber-Bosch, che prevede la reazione di azoto gassoso e idrogeno gassoso in presenza di un catalizzatore ad alta pressione e temperatura. Il gas di ammoniaca risultante può quindi reagire con un acido per produrre uno ione ammonio.
Usi degli ioni ammonio
Lo ione ammonio ha vari usi in ambienti industriali, agricoli e di laboratorio.
Serve un’ampia gamma di ambienti industriali, agricoli e di laboratorio, poiché agisce principalmente come fertilizzante in agricoltura, fornendo azoto facilmente disponibile alle piante e riducendo il pH del suolo.
L’industria chimica utilizza lo ione ammonio come ingrediente chiave nella produzione di vari composti, come fertilizzanti, esplosivi e prodotti farmaceutici, nonché nella sintesi di antibiotici e altri prodotti farmaceutici. Lo ione ammonio funziona anche come esplosivo sotto forma di nitrato di ammonio.
Nei laboratori, i ricercatori utilizzano lo ione ammonio come reagente in molte reazioni chimiche, come le reazioni di precipitazione e la sintesi organica, e come agente tampone per stabilizzare il pH della soluzione.
Inoltre, lo ione ammonio viene utilizzato nei prodotti per la pulizia della casa come agente antimicrobico grazie alla sua capacità di uccidere batteri e funghi.
I molteplici usi dello ione ammonio e la sua versatilità lo rendono un composto essenziale in vari settori e applicazioni.
