Lo ione acetato (C2H3O2-) è un anione composto da un atomo di carbonio, due atomi di idrogeno e un atomo di ossigeno, ampiamente presente in chimica organica e biochimica.
| Nome IUPAC | Etanoato |
| Formula molecolare | C2H3O2- |
| numero CAS | 127-09-3 |
| Sinonimi | Anione dell’acido acetico; Anione dell’acido etanoico; Anione acetato |
| InChI | InChI=1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4)/p-1 |
Riempitivo in acetato
Lo ione acetato è un anione, il che significa che trasporta una carica negativa. Lo ione acetato deriva dall’acido acetico , che è un acido organico debole che si dissocia in acqua per formare ioni idrogeno (H+) e ioni acetato (C2H3O2-). Lo ione acetato ha una carica pari a -1 ed è uno ione comune nei sistemi biologici e in molte reazioni chimiche.
Formula dell’acetato
Lo ione acetato ha la formula chimica C2H3O2-. È uno ione caricato negativamente composto da due atomi di carbonio, tre atomi di idrogeno e due atomi di ossigeno. Lo ione acetato è la base coniugata dell’acido acetico , che ha la formula chimica CH3COOH. Lo ione acetato forma sali con ioni caricati positivamente come sodio (Na+) e calcio (Ca2+) per produrre rispettivamente acetato di sodio (CH3COO-Na+) e acetato di calcio (CH3COO-Ca2+). ).
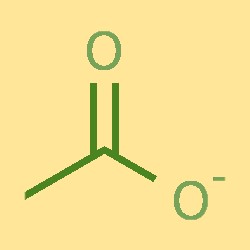
Struttura degli ioni acetato
Lo ione acetato è costituito da un atomo di carbonio, due atomi di idrogeno e un atomo di ossigeno. L’atomo di carbonio è legato a un atomo di ossigeno e due atomi di idrogeno, formando una struttura COH. L’atomo di ossigeno è anche legato a uno ione carico negativamente. Lo ione acetato ha una forma planare trigonale, con angoli di legame di circa 120°.
Massa molare dello ione acetato
La massa molare dello ione acetato (C2H3O2) è 59,04 g/mol. Si calcola sommando i pesi atomici di tutti gli atomi presenti nello ione. La massa molare è importante per determinare la quantità di sostanza presente in un campione.
Punto di ebollizione degli ioni acetato
Il punto di ebollizione dello ione acetato non è applicabile perché è uno ione caricato negativamente e non esiste come molecola a sé stante. Tuttavia, il punto di ebollizione dell’acido acetico, che contiene lo ione acetato, è 118,1°C.
Peso molecolare degli ioni acetato
Il peso molecolare dello ione acetato (C2H3O2) è 59,04 g/mol, che è la somma dei pesi atomici di tutti gli atomi dello ione. Il peso molecolare è utile per determinare la quantità di sostanza in un campione.
| Aspetto | Non applicabile (ione) |
| Peso specifico | Non applicabile (ione) |
| Colore | Non applicabile (ione) |
| Odore | Non applicabile (ione) |
| Massa molare | 59,04 g/mole |
| Densità | Non applicabile (ione) |
| Punto di fusione | Non applicabile (ione) |
| Punto di ebollizione | Non applicabile (ione) |
| Punto flash | Non applicabile (ione) |
| solubilità in acqua | Solubile in acqua |
| Solubilità | Solubile in acqua e solventi polari |
| Pressione del vapore | Non applicabile (ione) |
| Densità del vapore | Non applicabile (ione) |
| pKa | 4.76 |
| pH | Acido |
Sicurezza e pericoli degli ioni acetato
Lo ione acetato è generalmente considerato sicuro perché è uno ione naturale in molti prodotti alimentari e bevande. Tuttavia, soluzioni concentrate di acido acetico , che contengono lo ione acetato, possono essere dannose se ingerite, inalate o a contatto con la pelle e gli occhi, causando irritazioni o ustioni chimiche. Quando si maneggiano soluzioni concentrate di acido acetico è necessario utilizzare dispositivi di protezione e ventilazione adeguati.
| Simboli di pericolo | Irritante |
| Descrizione della sicurezza | S2 – Tenere fuori dalla portata dei bambini. S26 – In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico. S37 – Indossare guanti adatti. S60 – Questo materiale e il suo contenitore devono essere smaltiti come rifiuti pericolosi. |
| Numeri di identificazione delle Nazioni Unite | UN2790 |
| Codice SA | 2915.90.90 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | III |
| Tossicità | Lo ione acetato è considerato leggermente tossico se ingerito, ma le soluzioni concentrate di acido acetico (che contengono ioni acetato) possono essere dannose se ingerite, inalate o a contatto con la pelle e gli occhi. |
Metodi di sintesi degli ioni acetato
La sintesi dello ione acetato comporta solitamente la formazione di acido acetico , che è il composto genitore che contiene lo ione acetato. Un metodo comune per sintetizzare l’acido acetico prevede l’ossidazione dell’etanolo utilizzando un agente ossidante come l’acido cromico. Un altro metodo prevede la carbonilazione del metanolo utilizzando monossido di carbonio e un catalizzatore. L’acido acetico può anche essere prodotto biologicamente mediante la fermentazione dei carboidrati da parte di batteri acetogeni. Lo ione acetato può anche essere ottenuto mediante dissociazione dell’acido acetico in una soluzione, che rilascia lo ione acetato e gli ioni idrogeno. In alcuni casi lo ione acetato può essere ottenuto anche per reazione di un estere acetico con una base forte.
Usi degli ioni acetato
Lo ione acetato (C2H3O2), sotto forma di acido acetico , ha una varietà di scopi in tutti i settori. L’industria alimentare utilizza l’acido acetico come condimento e conservante per il suo sapore aspro e le proprietà antimicrobiche. L’industria tessile utilizza l’acido acetico come componente degli ammorbidenti e come fissativo dei coloranti. Nell’industria chimica, l’acido acetico funge da materia prima per la produzione di altri prodotti chimici come l’acetato di vinile, utilizzato negli adesivi e nei rivestimenti. L’industria farmaceutica utilizza gli ioni acetato come ingrediente nei farmaci e come tampone nei trattamenti medici. Inoltre, l’acetato di cellulosa, un tipo di plastica, è prodotto dall’acido acetico e trova applicazioni in pellicole e fibre ottiche.
