Lo ioduro di potassio (KI) è un composto chimico utilizzato per prevenire l’assorbimento dello iodio radioattivo da parte della ghiandola tiroidea. È efficace se assunto prima o subito dopo l’esposizione allo iodio radioattivo.
| Nome dell’IUPAC | Ioduro di potassio |
| Formula molecolare | KI |
| numero CAS | 7681-11-0 |
| Sinonimi | kaliumioduro, monoioduro di potassio, ioduro di K, KI |
| InChI | InChI=1S/HI.K/h1H;/q;+1/p-1 |
Proprietà dello ioduro di potassio
Formula dello ioduro di potassio
La formula dello ioduro di potassio è KI. Questa formula rappresenta il rapporto più semplice tra atomi di potassio e iodio nel composto. La formula dello ioduro di potassio viene utilizzata per calcolare la quantità di composto necessaria in varie applicazioni, nonché per determinarne il peso molecolare e altre proprietà.
Massa molare dello ioduro di potassio
Il KI ha una massa molare di circa 166,0028 g/mol. Questo valore viene calcolato sommando i pesi atomici di K e I nel composto, che sono rispettivamente 39,0983 g/mol e 126,9045 g/mol. La massa molare del KI è importante per determinare la quantità di composto necessaria in una determinata reazione o applicazione.
Punto di ebollizione dello ioduro di potassio
Il punto di ebollizione del KI è 1330°C (2426°F). Questo alto punto di ebollizione è dovuto al forte legame ionico tra gli atomi di potassio e iodio nel composto. Il KI viene utilizzato in applicazioni ad alta temperatura grazie alla sua capacità di resistere al calore estremo senza rompersi o perdere la sua efficacia.
Punto di fusione dello ioduro di potassio
Il punto di fusione del KI è 681°C (1.258°F). Questo punto di fusione relativamente basso rende il KI facile da maneggiare e lavorare a temperature moderate. Il composto è comunemente usato nella produzione di pellicole fotografiche, prodotti farmaceutici e medicina nucleare grazie al suo basso punto di fusione.
Densità dello ioduro di potassio g/mL
La densità del KI è 3,123 g/mL. Questo valore è superiore a quello dell’acqua, rendendo il KI relativamente pesante e denso. La densità del KI è importante nel determinare la sua solubilità in vari solventi e nelle sue applicazioni come radioprotettivo.
Peso molecolare dello ioduro di potassio
Il peso molecolare del KI è di circa 166,0028 g/mol. Questo valore rappresenta la somma dei pesi atomici degli elementi costitutivi del composto. Il peso molecolare del KI è importante per determinare le sue proprietà e per calcolare la sua concentrazione nelle soluzioni.
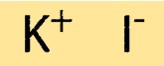
Struttura dello ioduro di potassio
Il KI ha una struttura cristallina semplice, costituita da una disposizione cubica centrata sulle facce di ioni K+ e ioni I-. Gli ioni sono tenuti insieme da forti legami ionici, che conferiscono al composto i suoi elevati punti di fusione e di ebollizione. La struttura cristallina del KI è importante per comprenderne le proprietà fisiche e chimiche.
| Aspetto | polvere cristallina bianca |
| Densità specifica | 3.123 |
| Colore | da incolore a bianco |
| Odore | inodore |
| Massa molare | 166,0028 g/mole |
| Densità | 3,123 g/ml |
| Punto di fusione | 681°C (1258°F) |
| Punto di ebollizione | 1330°C (2426°F) |
| Punto flash | non è applicabile |
| solubilità in acqua | 128 g/100 ml (20°C) |
| Solubilità | solubile in etanolo, acetone e glicerolo |
| Pressione del vapore | trascurabile |
| Densità del vapore | non è applicabile |
| pKa | 10.8 |
| pH | 6,0 – 9,0 (soluzione al 5%) |
Sicurezza e pericoli dello ioduro di potassio
Il KI è generalmente considerato sicuro se usato in modo appropriato. Tuttavia, come tutti i prodotti chimici, può rappresentare un pericolo se maneggiato in modo improprio o utilizzato in modo inappropriato. Il KI può irritare la pelle, gli occhi e il sistema respiratorio e un’esposizione prolungata può causare effetti sulla salute più gravi. È anche tossico se ingerito in grandi quantità. Quando si lavora con KI è necessario seguire le corrette procedure di manipolazione, stoccaggio e smaltimento. Inoltre, durante la manipolazione del composto è necessario indossare dispositivi di protezione individuale, come guanti e protezione per gli occhi.
| Simboli di pericolo | XI |
| Descrizione della sicurezza | Evitare di respirare polvere/fumi/gas/nebbia/vapori/aerosol. Indossare guanti protettivi/proteggere gli occhi/il viso. IN CASO DI INALAZIONE: trasportare la vittima all’aria aperta e mantenerla a riposo in una posizione che favorisca la respirazione. IN CASO DI CONTATTO CON GLI OCCHI: sciacquare accuratamente con acqua per diversi minuti. Rimuovere le lenti a contatto, se presenti ed è facile da fare. Continua a risciacquare. |
| Numeri di identificazione delle Nazioni Unite | ONU 3077 |
| Codice SA | 28276000 |
| Classe di pericolo | 9 – Materiali pericolosi vari |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto) > 10.000 mg/kg |
Metodi per la sintesi dello ioduro di potassio
Esistono diversi metodi per sintetizzare il KI, ma uno dei più comuni prevede la reazione dello iodio con idrossido di potassio o carbonato di potassio in acqua. L’equazione per questa reazione è:
I2 + 2KOH → KI + KIO3 + H2O
Il processo produce KI, iodato di potassio e acqua come sottoprodotti. Il riscaldamento della miscela scompone lo iodato di potassio e lascia KI puro.
Un altro metodo per sintetizzare il KI prevede la reazione dello iodio con bisolfito di potassio in acqua. Questa reazione produce KI e anidride solforosa come sottoprodotto. L’equazione per questa reazione è:
I2 + 2KHSO3 → 2KI + 2SO2 + H2O
Il KI ottenuto può essere purificato mediante ricristallizzazione in acqua calda.
Le alghe contengono alti livelli di iodio, che i chimici possono utilizzare per ottenere KI. Il processo prevede la combustione delle alghe per produrre cenere, la dissoluzione della cenere in acqua e il trattamento con idrossido di potassio per produrre KI.
Usi dello ioduro di potassio
Ecco alcuni usi comuni del KI:
- Protezione dalle radiazioni: utilizzata per proteggere la ghiandola tiroidea dalle radiazioni in caso di incidente o attacco nucleare. Funziona saturando la ghiandola tiroidea con iodio non radioattivo, che impedisce l’assorbimento degli isotopi di iodio radioattivo.
- Scopi medicinali: usato per trattare condizioni della tiroide come ipertiroidismo e gozzo. Utilizzato anche come integratore alimentare per prevenire la carenza di iodio.
- Fotografia: utilizzato come componente nelle emulsioni fotografiche.
- Chimica analitica: utilizzata in chimica analitica per determinare la concentrazione di agenti ossidanti in un campione.
- Chimica organica: utilizzato nelle reazioni di chimica organica come fonte di iodio.
- Nutrizione animale: utilizzato come additivo per mangimi per il bestiame per prevenire la carenza di iodio e migliorare la salute generale.
- Rilevamento dell’amido: utilizzato come reagente per rilevare la presenza di amido nelle soluzioni.
- Agente riducente: agisce come agente riducente in alcune reazioni chimiche.
Domande:
D: Dove posso acquistare lo ioduro di potassio vicino a me?
R: Puoi acquistare KI in molte farmacie, negozi di alimenti naturali e rivenditori online. Viene spesso venduto come integratore alimentare o come agente di protezione dalle radiazioni.
D: Quale gruppo di clienti non dovrebbe ricevere ioduro di potassio?
R: Le persone con determinate condizioni della tiroide o allergie allo iodio non dovrebbero assumere KI. È importante consultare un operatore sanitario prima di assumere qualsiasi integratore o farmaco.
D: Quale soluzione contiene il 6,0% (m/m) di ioduro di potassio (KI) in acqua?
R: Una soluzione al 6,0% (m/m) di KI in acqua significa che 6,0 grammi di KI vengono sciolti in 100 grammi di acqua.
D: Cos’è lo ioduro di potassio?
R: Il KI è un composto chimico composto da potassio e iodio. La sua formula chimica è KI.
D: Il KI è ionico o covalente?
R: Lo ioduro di potassio (KI) è un composto ionico. È formato dall’attrazione elettrostatica tra ioni potassio caricati positivamente e ioni ioduro caricati negativamente.
D: Il KI è solubile in acqua?
R: Sì, lo ioduro di potassio è altamente solubile in acqua. A temperatura ambiente in 100 ml di acqua si possono sciogliere circa 140 grammi di KI.
D: Cos’è il KI in chimica?
R: In chimica, KI è la formula chimica dello ioduro di potassio, un composto utilizzato in una varietà di applicazioni tra cui protezione dalle radiazioni, scopi medicinali e chimica analitica.
