L’ottano è un carburante ad alto numero di ottano utilizzato nei motori a combustione. Migliora le prestazioni del motore, riduce i colpi in testa e aumenta la potenza erogata. È comunemente usato nei veicoli ad alte prestazioni e nelle auto da corsa.
| Nome IUPAC | Ottano |
| Formula molecolare | C8H18 |
| numero CAS | 111-65-9 |
| Sinonimi | n-Ottano, Ottano normale, Ottano |
| InChI | InChI=1S/C8H18/c1-3-5-7-8-6-4-2/h3-8H2.1-2H3 |
Proprietà dell’ottano
Formula dell’ottano
La formula dell’ottano è C8H18. È costituito da otto atomi di carbonio e diciotto atomi di idrogeno. Questa formula molecolare rappresenta la disposizione degli atomi in una singola molecola di ottano.
Massa molare dell’ottano
La massa molare dell’ottano si calcola sommando le masse atomiche di tutti gli atomi presenti nella sua formula chimica. La massa molare dell’ottano è di circa 114,22 grammi per mole. Questo è importante in vari calcoli che coinvolgono la quantità di ottano in un dato campione.
Punto di ebollizione del numero di ottano
Octan ha un punto di ebollizione di circa 125,5 gradi Celsius (257,9 gradi Fahrenheit). Questa è la temperatura alla quale l’ottano passa dalla fase liquida a quella gassosa. Il punto di ebollizione dell’ottano è influenzato dalla sua struttura molecolare e dalle forze intermolecolari.
Punto di fusione dell’ottano
Octan ha un punto di fusione di circa -57 gradi Celsius (-70,6 gradi Fahrenheit). Questa è la temperatura alla quale l’ottano passa da solido a liquido. Il punto di fusione dell’ottano dipende da fattori quali la struttura molecolare e le forze intermolecolari.
Densità di ottano g/ml
La densità dell’ottano è di circa 0,703 grammi per millilitro (g/mL). La densità è una misura della massa per unità di volume di una sostanza. La densità dell’ottano è inferiore a quella dell’acqua, che ha una densità di 1 g/ml, indicando che l’ottano è meno denso dell’acqua.
Peso molecolare dell’ottano
Il peso molecolare dell’ottano è di circa 114,22 grammi per mole. È la somma dei pesi atomici di tutti gli atomi in una molecola di ottano. Il peso molecolare è cruciale in vari calcoli, come determinare la quantità di ottano necessaria in una reazione.
Struttura dell’ottano
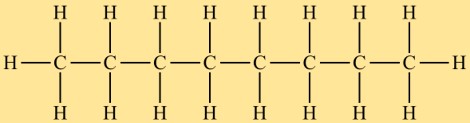
Octan appartiene alla classe degli alcani e ha una struttura lineare. È costituito da una catena di otto atomi di carbonio a cui sono attaccati atomi di idrogeno. La disposizione degli atomi nell’ottano è tale che non esiste una struttura ramificata o ciclica.
Solubilità del numero di ottano
Octan è considerato insolubile in acqua. Presenta una bassa solubilità nei solventi polari a causa della sua natura non polare. Tuttavia, l’ottano è altamente solubile in solventi non polari, come altri idrocarburi, oli e solventi organici.
| Aspetto | Liquido incolore |
| Peso specifico | 0,703 g/ml |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 114,22 g/mole |
| Densità | 0,703 g/ml |
| Punto di fusione | -57°C (-70,6°F) |
| Punto di ebollizione | 125,5°C (257,9°F) |
| Punto flash | -18°C (0°F) |
| solubilità in acqua | Insolubile |
| Solubilità | Solubile in solventi non polari |
| Pressione del vapore | 12,9 mmHg a 20°C |
| Densità del vapore | 3,47 (aria = 1) |
| pKa | ~45 |
| pH | Neutro |
Sicurezza e pericoli dell’ottano
Octan pone alcuni rischi per la sicurezza che devono essere considerati. È altamente infiammabile e può accendersi facilmente, presentando pericolo di incendio. I vapori di Octan possono formare miscele esplosive con l’aria, aumentando il rischio di incendi ed esplosioni. È importante maneggiare l’octan con cautela, garantendo un’adeguata ventilazione ed evitando fonti di ignizione. Il contatto della pelle con ottan può causare irritazione e secchezza. L’ingestione o l’inalazione di ottan può causare rischi per la salute, tra cui irritazione respiratoria ed effetti sul sistema nervoso centrale. È essenziale seguire le precauzioni di sicurezza, utilizzare dispositivi di protezione individuale adeguati e tenere l’octan lontano da sostanze incompatibili.
| Simboli di pericolo | Infiammabile (F), Irritante (Xi) |
| Descrizione della sicurezza | Tenere lontano da fonti di calore/scintille/fiamme libere. Utilizzare in un’area ben ventilata. Evitare il contatto con la pelle e gli occhi. |
| Numeri di identificazione delle Nazioni Unite | ONU 1262 |
| Codice SA | 2901.10.10 |
| Classe di pericolo | 3 – Liquidi infiammabili |
| Gruppo di imballaggio | III |
| Tossicità | Debole |
Metodi di sintesi dell’ottano
Vari metodi possono sintetizzare l’ottano. Un metodo comune consiste nel riformare cataliticamente le frazioni petrolifere come la nafta. Il processo riscalda la nafta e la fa passare su un catalizzatore, solitamente platino o renio, favorendo il riarrangiamento delle molecole di idrocarburi. Questo riarrangiamento produce composti di ottano più elevato, in particolare ottano.
Un altro metodo consiste nell’alchilare l’isobutano con buteni. L’acido solforico o acido fluoridrico , agendo come catalizzatori acidi, facilita la reazione dell’isobutano, un idrocarburo ramificato, con idrocarburi insaturi (buteni). Questa reazione forma molecole di ottano a catena ramificata.
L’isomerizzazione è un approccio aggiuntivo per produrre ottano. Converte gli idrocarburi a catena lineare come l’esano o l’eptano in isomeri a catena ramificata. Vari catalizzatori, tra cui zeoliti o catalizzatori al platino, possono catalizzare questo processo.
Inoltre, l’ottano può essere ottenuto idrogenando idrocarburi aromatici come toluene o xilene utilizzando idrogeno gassoso e un catalizzatore adatto. Questa reazione converte i composti aromatici in cicloesano, che può essere ulteriormente deidrogenato per produrre ottano.
Questi metodi di sintesi svolgono un ruolo importante nella produzione di ottano, ampiamente utilizzato come componente del carburante nella benzina. Utilizzando queste tecniche è possibile ottenere un ottano con il numero di ottano desiderato, garantendo prestazioni ed efficienza ottimali nei motori a combustione.
Usi dell’ottano
Octan trova vari usi in diversi settori grazie alle sue proprietà benefiche. Ecco alcune applicazioni chiave di Octan:
- Carburante: l’ottan viene utilizzato principalmente come componente del carburante nella benzina. Migliora il numero di ottani del carburante, migliorando le prestazioni del motore, riducendo i colpi e prevenendo danni al motore. Ciò è particolarmente importante nei veicoli ad alte prestazioni e nelle auto da corsa.
- Motori a combustione: Octan è fondamentale per i motori a combustione interna, compresi quelli di automobili, motociclette e piccoli motori. Fornisce la fonte di energia necessaria per il funzionamento e la propulsione di veicoli e macchine.
- Sintesi chimica: Octan funge da precursore per la produzione di vari prodotti chimici. Viene utilizzato come materia prima per la sintesi di altri composti idrocarburici, come alcoli, aldeidi e acidi.
- Solvente da laboratorio: Octan è utilizzato come solvente non polare nei laboratori. La sua bassa polarità lo rende adatto alla dissoluzione di composti non polari, consentendo ai ricercatori di eseguire determinati esperimenti ed estrazioni.
- Riferimento standard: per determinare i numeri di ottano e confrontare le prestazioni di diversi carburanti, ricercatori ed esperti utilizzano attivamente l’ottano come riferimento e composto di riferimento. Aiuta a stabilire standard per la qualità e l’efficienza della benzina e di altri combustibili idrocarburici.
- Calibrazione: Octan viene utilizzato nella calibrazione di apparecchiature, come i gascromatografi, per garantire misurazioni accurate e precise. Le sue proprietà note e il comportamento ben caratterizzato lo rendono uno standard di calibrazione affidabile.
- Ricerca e sviluppo: Octan è essenziale per scopi di ricerca e sviluppo nell’industria automobilistica e dei carburanti. Scienziati e ingegneri stanno studiando attivamente le proprietà, le caratteristiche di combustione e l’impatto ambientale dell’ottano per migliorare l’efficienza del carburante, ridurre le emissioni e innovare i carburanti alternativi.
Octan alimenta attivamente i trasporti, consente la sintesi chimica, facilita il lavoro di laboratorio e guida i progressi nei settori automobilistico ed energetico.
Domande:
D: Quale composto ha il punto di fusione più alto?
R: Al2(CO3)3.
D: Qual è l’entalpia standard di formazione di questo isomero C8H18(g)?
R: L’entalpia standard di formazione dell’isomero C8H18(g) è specifica per il particolare isomero e richiederebbe la sua identificazione per determinare il valore.
D: Qual è la massa in grammi di 5,90 moli di C8H18?
R: La massa di 5,90 moli di C8H18 è di circa 789,26 grammi.
D: Quale affermazione confronta meglio il punto di fusione del butano (C4H10) con quello dell’ottano (C8H18)?
R: L’ottano (C8H18) ha un punto di fusione più elevato del butano (C4H10).
D: Qual è il nome di C8H18?
R: Il nome di C8H18 è ottano.
D: Cos’è l’ottano?
R: L’ottano è un idrocarburo alcano con la formula molecolare C8H18. È comunemente usato come componente combustibile nella benzina.
D: Qual è il numero di ottani della benzina?
R: Il numero di ottano della benzina si riferisce alla sua capacità di resistere ai colpi durante la combustione. Indica le proprietà antidetonanti del carburante e la sua idoneità per motori ad alta compressione.
D: Cosa sono il numero di ottano e il numero di cetano?
R: Il numero di ottano misura le proprietà antidetonanti della benzina, mentre il numero di cetano misura la qualità di accensione del gasolio.
D: Cos’è l’ottano?
R: Il valore Octan è un valore numerico che rappresenta la prestazione di un carburante nel resistere ai colpi durante la combustione. Indica la capacità del carburante di resistere alla compressione prima dell’accensione.
D: Qual è il nome dell’idrocarburo CH3(CH2)6CH3?
R: Il nome dell’idrocarburo CH3(CH2)6CH3 è ottano.
