L’idrossido di magnesio (Mg(OH)2) è un antiacido e lassativo usato per trattare il bruciore di stomaco, l’indigestione e la stitichezza. Funziona neutralizzando l’acido dello stomaco e attirando acqua nel colon per favorire i movimenti intestinali.
| Nome IUPAC | Idrossido di magnesio |
| Formula molecolare | Mg(OH)2 |
| numero CAS | 1309-42-8 |
| Sinonimi | Latte di magnesia; brucite; Diidrossido di magnesio; Idromagnesite; Magnesia bianca |
| InChI | InChI=1S/2H2O.Mg/h2*1H2;/q;;+2/p-2 |
Proprietà dell’idrossido di magnesio
Formula di idrossido di magnesio
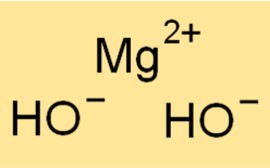
La formula chimica dell’idrossido di magnesio è Mg(OH)2. Questa formula indica che un atomo di magnesio è legato a due ioni idrossido. La formula dell’idrossido di magnesio viene utilizzata per calcolare la massa molare, la densità e altre proprietà fisiche della sostanza. La formula fornisce anche informazioni sulla struttura della sostanza, poiché indica il numero e il tipo di atomi presenti in una molecola di idrossido di magnesio.
Massa molare dell’idrossido di magnesio
La massa molare di Mg(OH)2 è 58,32 g/mol. Questa è la massa di una mole di Mg(OH)2, che contiene una mole di atomi di Mg e due moli di ioni OH-. La massa molare è un concetto importante in chimica perché viene utilizzata per calcolare la quantità di sostanza contenuta in un dato campione.
Punto di ebollizione dell’idrossido di magnesio
Mg(OH)2 non ha un punto di ebollizione distinto perché si decompone prima di raggiungere il punto di ebollizione. La temperatura di decomposizione di Mg(OH)2 è di circa 350°C. Quando riscaldato, Mg(OH)2 si decompone per formare ossido di magnesio e acqua.
Punto di fusione dell’idrossido di magnesio
Il punto di fusione di Mg(OH)2 è 350°C. A questa temperatura, il Mg(OH)2 solido passa allo stato liquido. Questo processo è noto come fusione. Il punto di fusione è una proprietà fisica importante di una sostanza perché determina la temperatura alla quale un solido si trasforma in un liquido.
Densità dell’idrossido di magnesio g/mL
La densità di Mg(OH)2 è di circa 2,36 g/mL. La densità è definita come la massa di una sostanza per unità di volume. Mg(OH)2 è una sostanza relativamente densa a causa della sua elevata massa molare e della presenza di due ioni OH- per atomo di Mg.
Peso molecolare dell’idrossido di magnesio
Il peso molecolare di Mg(OH)2 è 58,32 g/mol. È la somma dei pesi atomici di tutti gli atomi presenti in una molecola di Mg(OH)2. Il peso molecolare è un concetto utile in chimica perché viene utilizzato per determinare la quantità di una sostanza in un dato campione.
Struttura dell’idrossido di magnesio
Mg(OH)2 ha una struttura a strati composta da ioni Mg2+ e ioni OH-. Gli ioni Mg2+ sono circondati da sei ioni OH- e gli ioni OH- sono disposti in una struttura esagonale compatta. La struttura stratificata di Mg(OH)2 dà origine alle sue proprietà caratteristiche, come la sua bassa solubilità in acqua e la sua capacità di formare una sospensione in acqua.
| Aspetto | Polvere bianca o sospensione |
| Peso specifico | 2,36 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 58,32 g/mole |
| Densità | 2,36 g/ml |
| Punto di fusione | 350°C |
| Punto di ebollizione | Si decompone a 350°C |
| Punto flash | Non applicabile |
| solubilità in acqua | 12 mg/l a 20°C |
| Solubilità | Insolubile in etanolo ed etere |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | 10.4 |
| pH | 10.5 |
Sicurezza e pericoli dell’idrossido di magnesio
Il Mg(OH)2 è generalmente considerato sicuro da maneggiare e utilizzare, con bassa tossicità e nessun effetto cancerogeno noto. Tuttavia, l’esposizione prolungata alla polvere o alla polvere di Mg(OH)2 può causare irritazione respiratoria e danni ai polmoni. Mg(OH)2 può anche causare irritazione o corrosione degli occhi, della pelle e delle mucose al contatto. È importante seguire le opportune precauzioni di sicurezza quando si maneggia Mg(OH)2, come indossare dispositivi di protezione e lavorare in un’area ben ventilata. In caso di contatto o esposizione, consultare un medico e sciacquare abbondantemente con acqua le aree interessate.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | – Evitare l’inalazione e il contatto con gli occhi, la pelle e gli indumenti. – Indossare indumenti protettivi, guanti e proteggere gli occhi/il viso. – Utilizzare in un’area ben ventilata. |
| Numeri di identificazione delle Nazioni Unite | Non regolato |
| Codice SA | 2826.90.90 |
| Classe di pericolo | Non classificato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità; l’esposizione prolungata può causare irritazione respiratoria e danni ai polmoni. |
Metodi di sintesi dell’idrossido di magnesio
Vari metodi possono sintetizzare Mg(OH)2, come la precipitazione, la sintesi idrotermale e la deposizione elettrochimica.
Il metodo di precipitazione prevede la reazione dell’idrossido di sodio o dell’idrossido di ammonio con cloruro di magnesio o solfato di magnesio per formare Mg(OH)2. La reazione produce Mg(OH)2, che qualcuno può poi raccogliere ed essiccare.
Per eseguire la sintesi idrotermale, è necessario riscaldare l’acqua ad alta pressione e temperatura aggiungendo ossido di magnesio o carbonato di magnesio . Il processo produrrà Mg(OH)2 e potrai raccogliere i cristalli raffreddando la soluzione risultante.
La deposizione elettrochimica prevede il passaggio di una corrente elettrica attraverso una soluzione di ioni magnesio, facendoli reagire con gli ioni idrossido e formando Mg(OH)2 sul catodo.
Altri metodi per sintetizzare Mg(OH)2 includono l’uso di ossido di magnesio e latte di calce e la decomposizione termica del bicarbonato di magnesio.
Ciascun metodo presenta vantaggi e svantaggi in termini di efficacia, efficienza e costi. La scelta del metodo di sintesi dipende dall’applicazione specifica e dalle proprietà desiderate del prodotto Mg(OH)2.
Usi dell’idrossido di magnesio
Mg(OH)2 ha un’ampia gamma di applicazioni in vari settori, tra cui:
- Antiacido: comunemente usato come antiacido per neutralizzare l’acido dello stomaco e alleviare il bruciore di stomaco, l’indigestione e altri disturbi digestivi.
- Ritardante di fiamma: un ritardante di fiamma non tossico utilizzato nella plastica, nella gomma e nei tessuti per ridurre il rischio di incendio.
- Regolazione del pH: utilizzato per regolare il pH di vari prodotti, tra cui soluzioni per il trattamento dell’acqua, cosmetici e prodotti farmaceutici.
- Bonifica ambientale: utilizzato nel trattamento delle acque reflue e nel drenaggio acido delle miniere per neutralizzare le condizioni acide e rimuovere i metalli pesanti.
- Fertilizzante: utilizzato come fertilizzante per fornire magnesio alle piante e migliorare il pH del terreno.
- Applicazioni mediche: utilizzato come lassativo e in alcune procedure mediche, come la colonscopia, per pulire l’intestino.
- Altre applicazioni: utilizzato come stabilizzante nelle vernici al lattice, come agente sbiancante nella carta e come agente lucidante nel vetro e nella ceramica.
Domande:
D: Qual è la base utilizzata nel dentifricio?
R: Mg(OH)2 è comunemente usato come base nei dentifrici per aiutare a neutralizzare le condizioni acide nella bocca e ridurre il rischio di carie.
D: Qual è la formula dell’idrossido di magnesio?
R: La formula chimica dell’idrossido di magnesio è Mg(OH)2.
D: Quale equazione chimica mostra la dissociazione dell’idrossido di magnesio?
R: L’equazione chimica per la dissociazione di Mg(OH)2 è
Mg(OH)2 → Mg2+ + 2OH-.
D: L’idrossido di magnesio è solubile in acqua?
R: Mg(OH)2 è scarsamente solubile in acqua, il che significa che si dissolve in misura molto limitata.
D: Quale delle seguenti sostanze è un acido Arrhenius? BF3, HCN, NH3, Mg(OH)2?
R: Nessuna delle sostanze elencate è acido Arrhenius. BF3 e HCN sono acidi di Lewis, NH3 è una base di Arrhenius debole e Mg(OH)2 è una base di Arrhenius forte.
D: Il Mg(OH)2 è solubile in acqua?
R: Mg(OH)2 è scarsamente solubile in acqua, il che significa che si dissolve in misura molto limitata.
D: Qual è la massa molare di Mg(OH)2?
R: La massa molare di Mg(OH)2 è circa 58,32 g/mol.
D: Mg(OH)2 è un acido o una base?
R: Mg(OH)2 è una base perché è in grado di accettare ioni idrogeno (protoni) per formare acqua e un sale.
