L’idrossido di calcio (Ca(OH)2) è un composto chimico utilizzato in varie applicazioni come la produzione alimentare, il trattamento delle acque e l’edilizia. È ottenuto mescolando ossido di calcio con acqua e ha un aspetto bianco e polveroso.
| Nome dell’IUPAC | Idrossido di calcio |
| Formula molecolare | Ca(OH)2 |
| numero CAS | 1305-62-0 |
| Sinonimi | Calce spenta, calce idrata, latte di calce, calce marinata |
| InChI | InChI=1S/Ca.2H2O/h;2*1H2/q+2;;/p-2 |
Proprietà dell’idrossido di calcio
Formula dell’idrossido di calcio
La formula chimica dell’idrossido di calcio è Ca(OH)2. Ciò significa che ogni molecola di idrossido di calcio contiene uno ione Ca2+ e due ioni OH-. La formula è importante in chimica perché rappresenta il numero e il tipo di atomi in un composto.
Massa molare dell’idrossido di calcio
Ca(OH)2 ha una massa molare di 74,09 g/mol. È composto da un atomo di calcio, due atomi di ossigeno e due atomi di idrogeno. La massa molare è una proprietà importante in chimica perché viene utilizzata per calcolare la quantità di una sostanza contenuta in un dato campione.
Punto di ebollizione dell’idrossido di calcio
Ca(OH)2 ha un punto di ebollizione molto alto di 2400°C. Ciò significa che è necessaria una quantità significativa di calore per trasformarlo da liquido a gas. L’alto punto di ebollizione è dovuto ai forti legami ionici tra gli ioni calcio e idrossido.
Punto di fusione dell’idrossido di calcio
Ca(OH)2 ha un punto di fusione relativamente basso di 580°C. Ciò significa che può essere facilmente fuso e modellato in diverse forme. Il basso punto di fusione è dovuto alla natura ionica del composto, che consente agli ioni di muoversi più liberamente quando riscaldati.
Densità dell’idrossido di calcio g/mL
La densità di Ca(OH)2 è 2,24 g/mL. Ciò significa che è un composto relativamente pesante, rispetto all’acqua che ha una densità di 1 g/mL. L’elevata densità è dovuta alla natura molto compatta degli ioni Ca2+ e OH-.
Peso molecolare dell’idrossido di calcio
Il peso molecolare di Ca(OH)2 è 74,09 g/mol. Questa è la somma dei pesi atomici degli atomi di calcio, ossigeno e idrogeno nel composto. Il peso molecolare è una proprietà importante in chimica, poiché viene utilizzato per calcolare vari parametri come la molarità e la percentuale di composizione.
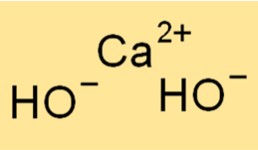
Struttura dell’idrossido di calcio
Ca(OH)2 ha una struttura cristallina, con ciascuno ione calcio circondato da sei ioni idrossido in una disposizione ottaedrica. Questa struttura conferisce al composto il suo caratteristico aspetto bianco e polveroso. I legami ionici tra gli ioni Ca2+ e OH- sono forti, conferendo al composto alti punti di fusione e di ebollizione.
| Aspetto | polvere bianca |
| Peso specifico | 2,24 g/cm³ |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 74,09 g/mole |
| Densità | 2,24 g/cm³ |
| Punto di fusione | 580°C |
| Punto di ebollizione | 2.400°C |
| Punto flash | Non applicabile |
| solubilità in acqua | 1,7 g/l (20°C) |
| Solubilità | Solubile negli acidi |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 12.5 (prima dissociazione) |
| pH | 12,5 (soluzione 0,1 M, 25°C) |
Sicurezza e pericoli dell’idrossido di calcio
Il Ca(OH)2 è generalmente considerato sicuro se maneggiato correttamente. Tuttavia può essere dannoso se ingerito, inalato o se entra in contatto con la pelle o gli occhi. Ciò può causare irritazioni, ustioni e problemi respiratori. La polvere del composto può anche irritare il sistema respiratorio. Quando si maneggia Ca(OH)2 è necessario indossare dispositivi di protezione come guanti, occhiali e respiratori. Il composto deve inoltre essere conservato in un’area fresca, asciutta e ben ventilata, lontano da materiali incompatibili. In caso di contatto o ingestione consultare immediatamente un medico.
| Simboli di pericolo | Xi (irritante) |
| Descrizione della sicurezza | Indossare guanti protettivi e proteggere gli occhi/il viso. |
| Numeri di identificazione delle Nazioni Unite | Un 1910 |
| Codice SA | 2825.90.90 |
| Classe di pericolo | 8 – Sostanze corrosive |
| Gruppo di imballaggio | III |
| Tossicità | L’idrossido di calcio è generalmente considerato non tossico se maneggiato correttamente. Tuttavia, l’ingestione o l’inalazione possono irritare e bruciare il sistema respiratorio e il tratto digestivo. |
Metodi per la sintesi dell’idrossido di calcio
Vari metodi possono sintetizzare Ca(OH)2.
Un metodo comune per sintetizzare Ca(OH)2 è quello di far reagire l’acqua con l’ossido di calcio , con conseguente formazione di calce spenta o calce idrata.
Un altro metodo prevede la reazione del cloruro di calcio con idrossido di sodio. La reazione dell’acqua e dell’anidride carbonica con il carbonato di calcio produce Ca(OH)2.
Il processo di idratazione prevede la miscelazione di acqua con ossido di calcio utilizzando il metodo della calce spenta. Questa reazione produce Ca(OH)2 e calore come sottoprodotto. Il processo rimuove ulteriormente le impurità e l’acqua in eccesso dalla pasta risultante.
Il metodo del cloruro di calcio prevede la miscelazione di cloruro di calcio e idrossido di sodio in un processo chiamato doppia decomposizione.
Questa reazione produce Ca(OH)2 e cloruro di sodio come sottoprodotti. Il Ca(OH)2 risultante viene quindi purificato ed essiccato.
Nel metodo del carbonato di calcio, il carbonato di calcio viene prima riscaldato per produrre ossido di calcio e anidride carbonica. Il processo di idratazione prevede la miscelazione dell’ossido di calcio con acqua, che produce Ca(OH)2.
Usi dell’idrossido di calcio
Ca(OH)2 ha molti usi in vari settori, tra cui:
- Edilizia: utilizzato come componente chiave nella produzione di calcestruzzo, malta e stucco grazie alla sua capacità di rafforzare e aumentare la durabilità di questi materiali.
- Agricoltura: utilizzato come ammendante del suolo per ridurre l’acidità del suolo e migliorare la fertilità del suolo.
- Trattamento dell’acqua: utilizzato per addolcire l’acqua rimuovendo impurità come ioni magnesio e calcio.
- Produzione chimica: utilizzata nella produzione di vari prodotti chimici come stearato di calcio, ipoclorito di calcio e fosfato di calcio.
- Industria alimentare: utilizzato come additivo alimentare per regolare i livelli di acidità nei prodotti alimentari come sottaceti, olive e bevande analcoliche.
- Industria medica: utilizzato in varie procedure dentistiche, come trattamenti canalari e otturazioni di cavità, grazie alle sue proprietà antimicrobiche e antifungine.
- Industria della pasta di legno e della carta: utilizzato nella produzione della carta per migliorare la lucentezza e la resistenza della carta.
- Industria della pelle: utilizzato nella lavorazione della pelle per rimuovere peli e impurità.
Domande:
D: L’idrossido di calcio è solubile?
R: Ca(OH)2 è moderatamente solubile in acqua, con una solubilità di circa 1,2 g/L a temperatura ambiente.
D: Qual è la formula dell’idrossido di calcio?
R: La formula dell’idrossido di calcio è Ca(OH)2.
D: Dove acquistare l’idrossido di calcio vicino a me?
R: Il Ca(OH)2 può essere acquistato nei negozi di prodotti chimici, nei negozi di ferramenta o nei rivenditori online. Puoi cercare negozi di prodotti chimici o ferramenta vicino alla tua zona o controllare rivenditori online come Amazon o eBay.
D: Ca(OH)2 è un acido o una base?
R: Ca(OH)2 è una base. È una base forte che si dissocia completamente in acqua per formare ioni calcio (Ca2+) e ioni idrossido (OH-).
D: Quando si verifica la reazione H3PO4(aq)+Ca(OH)2(aq)→, qual è la formula del sale formato?
R: La reazione tra H3PO4(aq) e Ca(OH)2(aq) produce fosfato di calcio (Ca3(PO4)2) e acqua (H2O) rispettivamente come sale e sottoprodotto.
D: Il Ca(OH)2 è solubile in acqua?
R: Sì, Ca(OH)2 è moderatamente solubile in acqua. Può dissolversi in acqua per formare una soluzione satura con una concentrazione di circa 1,2 g/L a temperatura ambiente.
D: Ca(OH)2 è una base forte?
R: Sì, Ca(OH)2 è una base forte. È un composto altamente basico che si dissocia completamente in acqua per formare ioni Ca2+ e OH-, rendendolo una base forte.
D: Quali vengono prodotti quando HCl reagisce con Ca(OH)2?
R: Quando HCl reagisce con Ca(OH)2, i prodotti formati sono cloruro di calcio (CaCl2) e acqua (H2O), perché gli ioni H+ di HCl reagiscono con gli ioni OH- di Ca(OH)2 per formare acqua, mentre i restanti ioni Ca2+ e Cl- formano il sale, cloruro di calcio.
