L’idrossido di bario è un composto chimico con la formula Ba(OH)2. È un solido cristallino bianco altamente solubile in acqua e comunemente utilizzato nei laboratori e nei processi industriali.
| Nome IUPAC | Diidrossido di bario |
| Formula molecolare | Ba(OH)2 |
| numero CAS | 17194-00-2 |
| Sinonimi | Bario (II) idrossido, barite, bario idrato, bario diidrato, bis (bario idrossido), bis (ossidanil) bario idrato |
| InChI | InChI=1S/Ba.2H2O/h;2*1H2/q+2;;/p-2 |
Massa molare dell’idrossido di bario
L’idrossido di bario ha una massa molare di 171,34 g/mol. È composto da uno ione bario (Ba2+) e due ioni idrossido (OH-), ciascuno avente una massa molare rispettivamente di 137,33 g/mol e 17,01 g/mol. La massa molare dell’idrossido di bario è importante per determinare la quantità di composto necessaria per le reazioni o per calcolare la concentrazione di una soluzione.
Formula di idrossido di bario
La formula chimica dell’idrossido di bario è Ba(OH)2. È costituito da uno ione bario (Ba2+) e due ioni idrossido (OH-). La formula dell’idrossido di bario è importante per determinare la quantità di composto necessaria nelle reazioni o per calcolare la concentrazione di una soluzione. Viene anche utilizzato per rappresentare la struttura del composto e il suo comportamento in soluzione.
Punto di ebollizione di Ba(OH)2
Il punto di ebollizione del Ba(OH)2 non è ben definito perché si decompone prima di essere bollito. Ba(OH)2 è una base forte e reagisce facilmente con l’anidride carbonica presente nell’aria, formando carbonato di bario e acqua. La temperatura di decomposizione del Ba(OH)2 dipende dalla concentrazione della soluzione, ma è generalmente superiore a 780°C.
Punto di fusione del Ba(OH)2
Ba(OH)2 ha un punto di fusione di 407°C. Esiste allo stato solido sotto forma di cristalli bianchi e inodore. Quando riscaldato, Ba(OH)2 subisce una reazione reversibile per formare ossido di bario e acqua. Il punto di fusione di Ba(OH)2 è importante per determinare la temperatura alla quale può essere maneggiato e conservato in sicurezza.
Ba(OH)2 densità g/ml
La densità del solido Ba(OH)2 è 3,22 g/cm3. In soluzione, la densità varia a seconda della concentrazione. Ad esempio, una soluzione al 10% di Ba(OH)2 ha una densità di 1,17 g/cm3. La densità di Ba(OH)2 è importante per determinare il volume di una soluzione necessaria per le reazioni o quando si maneggia il composto.
Peso molecolare Ba(OH)2
Il peso molecolare di Ba(OH)2 è 171,34 g/mol. È la somma dei pesi atomici di uno ione bario e due ioni idrossido. Il peso molecolare di Ba(OH)2 è importante per determinare la quantità di composto necessaria nelle reazioni o per calcolare la concentrazione di una soluzione.
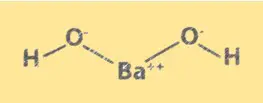
Struttura Ba(OH)2
Ba(OH)2 ha una struttura cristallina simile al cloruro di sodio. È costituito da ioni Ba2+ e ioni OH-, disposti in un reticolo cubico. Gli ioni Ba2+ occupano gli angoli del cubo e gli ioni OH- occupano il centro di ciascuna faccia. La struttura di Ba(OH)2 è importante per comprenderne le proprietà chimiche e il comportamento in soluzione.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 3,22 g/cm3 (solido) |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 171,34 g/mole |
| Densità | 2,18 g/cm3 (soluzione acquosa, 10% p/p a 25°C) |
| Punto di fusione | 407°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile in acqua |
| Solubilità | Solubile in alcool e acetone |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Alcalino (pH > 7) |
Nota: i valori forniti in questa tabella sono descrizioni generali e possono variare a seconda delle condizioni e delle concentrazioni specifiche della sostanza.
Sicurezza e pericoli dell’idrossido di bario
Ba(OH)2 è una sostanza altamente caustica e tossica che può causare grave irritazione alla pelle, agli occhi e al tratto respiratorio. È importante maneggiarlo con cura e indossare adeguati dispositivi di protezione individuale, come guanti e occhiali di sicurezza. Se inalato o ingerito può causare gravi danni ai polmoni, all’apparato digerente e ai reni. Dovrebbe essere conservato in un’area fresca, asciutta e ben ventilata, lontano da materiali incompatibili come acidi e ossidanti. In caso di fuoriuscita o esposizione, seguire le procedure di emergenza appropriate, come evacuare l’area e richiedere immediatamente assistenza medica.
| Simboli di pericolo | Corrosivo |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi; Indossare indumenti e guanti protettivi; Utilizzare solo in aree ben ventilate |
| Identificatori AN | ONU 1564 |
| Codice SA | 2816.40.00 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | II |
| Tossicità | Tossico per ingestione, inalazione e assorbimento cutaneo; Provoca grave irritazione della pelle e degli occhi; Può causare irritazione delle vie respiratorie e danni ai reni |
Metodi per la sintesi dell’idrossido di bario
Ba(OH)2 può essere sintetizzato con diversi metodi, inclusa la reazione dell’ossido di bario (BaO) con acqua (H2O) o la reazione del cloruro di bario (BaCl2) con idrossido di sodio (NaOH).
Nel primo metodo, l’ossido di bario viene aggiunto lentamente all’acqua distillata mescolando costantemente fino al raggiungimento della concentrazione desiderata. La soluzione risultante viene quindi filtrata ed essiccata per ottenere la forma solida di Ba(OH)2.
Nel secondo metodo, una soluzione di cloruro di bario viene aggiunta lentamente ad una soluzione di idrossido di sodio agitando costantemente fino al raggiungimento del pH desiderato. La soluzione risultante viene quindi filtrata ed essiccata per ottenere la forma solida di Ba(OH)2.
Un altro metodo prevede la reazione del solfuro di bario (BaS) con l’acqua, producendo Ba(OH)2 e gas di idrogeno solforato (H2S).
Ba(OH)2 può anche essere preparato mediante elettrolisi di sali di bario fusi o mediante decomposizione termica del carbonato di bario (BaCO3) ad alta temperatura.
Nel complesso, la sintesi di Ba(OH)2 richiede un’attenta manipolazione e adeguate precauzioni di sicurezza a causa delle sue proprietà altamente caustiche e tossiche. È importante seguire i protocolli e le normative di sicurezza adeguati quando si lavora con materiali pericolosi.
Usi dell’idrossido di bario
Ba(OH)2 ha diversi usi industriali e di laboratorio grazie alla sua natura altamente reattiva e alle proprietà alcaline. Uno dei suoi usi principali è come reagente chimico nella produzione di vari prodotti chimici, inclusi lubrificanti, plastica e pesticidi.
Ba(OH)2 viene utilizzato anche come stabilizzante nel PVC e in altre plastiche per prevenire lo scolorimento e il degrado causati dal calore e dall’esposizione ai raggi UV. Viene utilizzato anche nella produzione di alcuni tipi di vetro, come il vetro ottico e il vetro ad alto indice di rifrazione.
In laboratorio, Ba(OH)2 viene utilizzato come catalizzatore in varie reazioni organiche, come reazioni di esterificazione e transesterificazione. Viene utilizzato anche come titolante in chimica analitica per la determinazione di acidi deboli e nella preparazione di soluzioni standard.
Un’altra applicazione del Ba(OH)2 è la produzione di ossido di bario, utilizzato nella fabbricazione di tubi a raggi catodici per televisori e monitor di computer.
Ba(OH)2 viene utilizzato anche nel trattamento delle acque reflue industriali per rimuovere le impurità e neutralizzare gli effluenti acidi o alcalini prima dello scarico nell’ambiente.
Nel complesso, Ba(OH)2 svolge un ruolo essenziale in molte industrie e laboratori, contribuendo alla produzione di numerosi prodotti e processi.
Domande:
L’idrossido di bario è solubile?
Sì, l’idrossido di bario è solubile in acqua. Quando disciolto in acqua forma una soluzione alcalina con un pH di circa 12,5. La solubilità di Ba(OH)2 in acqua è relativamente elevata, con una solubilità di circa 3,52 g/100 mL a temperatura ambiente (25 °C). La solubilità di Ba(OH)2 può essere influenzata da fattori quali temperatura, pressione e presenza di altre sostanze nella soluzione.
L’idrossido di bario è una base forte?
Sì, l’idrossido di bario è una base forte. Quando disciolto in acqua, si dissocia completamente per formare ioni bario (Ba2+) e ioni idrossido (OH-) nella soluzione. Questa dissociazione produce una soluzione altamente alcalina con un pH di circa 12,5. Le forti proprietà basiche del Ba(OH)2 lo rendono un efficace neutralizzatore degli effluenti acidi e un catalizzatore in varie reazioni organiche.
Qual è la formula dell’idrossido di bario?
La formula dell’idrossido di bario è Ba(OH)2. Questa formula indica che ciascuna molecola di idrossido di bario contiene uno ione bario (Ba2+) e due ioni idrossido (OH-). Lo ione bario ha carica +2, mentre lo ione idrossido ha carica -1. I due ioni idrossido in Ba(OH)2 bilanciano la carica +2 dello ione bario per creare un composto neutro. La formula di Ba(OH)2 è importante per comprenderne le proprietà e le reazioni, nonché per calcolare la sua massa molare e altre proprietà fisico-chimiche.
