L’acido formico o HCOOH è un liquido incolore con un odore pungente. È ampiamente utilizzato come agente conservante e antibatterico e nella produzione di pelle, tessuti e gomma.
| Nome IUPAC | Acido metanoico |
| Formula molecolare | HCOOH |
| numero CAS | 64-18-6 |
| Sinonimi | Acido idrogeno carbossilico, acido formilico, amminoacido, acido formilico, acido metacarbonico, acido tionilformico, ecc. |
| InChI | InChI=1S/CH2O2/c2-1-3/h1H,(H,2,3) |
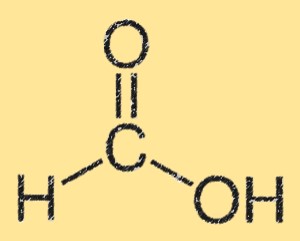
Struttura dell’acido formico
La struttura dell’acido formico è caratterizzata da un gruppo acido carbossilico (-COOH) attaccato a un singolo atomo di carbonio. L’atomo di carbonio è anche legato a un atomo di idrogeno e a un atomo di ossigeno. La struttura dell’acido formico è planare e presenta legami idrogeno tra i gruppi dell’acido carbossilico. Il legame idrogeno dà origine alla sua elevata solubilità in acqua.
Formula dell’acido formico
La formula chimica dell’acido formico è HCOOH. È un composto organico semplice che contiene un atomo di carbonio, un atomo di ossigeno e due atomi di idrogeno. La formula dell’acido formico è importante per determinarne le proprietà chimiche e fisiche, nonché il suo comportamento in diverse condizioni. Viene anche utilizzato in vari calcoli chimici, come la stechiometria e la molarità.
Struttura di Lewis HCOOH
La struttura di Lewis dell’acido formico (HCOOH) è la seguente:
H
|
C=O
|
OH
L’atomo di carbonio è al centro della struttura con quattro elettroni di valenza. Forma legami singoli con i due atomi di idrogeno e l’atomo di ossigeno, che ha due coppie di elettroni liberi. L’atomo di ossigeno forma anche un doppio legame con l’altro atomo di carbonio, che trasporta una coppia di elettroni liberi. La struttura di Lewis mostra che la molecola ha un legame covalente polare dovuto alla differenza di elettronegatività tra gli atomi di carbonio e di ossigeno.
Massa molare dell’acido formico
La massa molare dell’acido formico, chiamato anche acido metanoico, è 46,03 g/mol. La sua formula chimica è HCOOH, che indica che contiene un atomo di carbonio, uno di ossigeno e due di idrogeno. La massa molare è un parametro importante per determinare la quantità di una sostanza necessaria per preparare una soluzione di una concentrazione specifica. Ad esempio, per preparare una soluzione 1 M di acido formico, sarebbe necessario sciogliere 46,03 g di acido formico in 1 litro di solvente.
Punto di ebollizione dell’acido formico
Il punto di ebollizione di HCOOH è 100,8°C (213,4°F). È un liquido incolore che ha un odore pungente ed è molto solubile in acqua. Il punto di ebollizione dell’HCOOH è relativamente basso, il che significa che può essere facilmente vaporizzato e distillato. Questa proprietà lo rende utile in varie applicazioni industriali, come la produzione di coloranti, plastica e prodotti farmaceutici.
HCOOH Punto di fusione
Il punto di fusione di HCOOH è 8,4°C (47,1°F). È un solido a temperatura ambiente e può essere ottenuto nella sua forma pura raffreddandolo al di sotto del punto di fusione. I cristalli di HCOOH sono bianchi ed emanano un odore pungente. Il punto di fusione dell’HCOOH è relativamente basso rispetto ad altri acidi carbossilici, rendendolo un solvente utile per alcune reazioni chimiche.
Densità HCOOH g/mL
La densità di HCOOH è 1.220 g/mL a 25°C (77°F). È più denso dell’acqua, che alla stessa temperatura ha una densità di 1000 g/ml. La densità di HCOOH è una proprietà importante che determina la sua solubilità in acqua e altri solventi. Ciò influisce anche sul suo comportamento in diverse condizioni, come temperatura e pressione.
Peso molecolare dell’acido formico
Il peso molecolare dell’acido formico è 46,03 g/mol. È un composto organico semplice con la formula chimica HCOOH. Il peso molecolare è un parametro importante per determinare le proprietà fisiche e chimiche di una sostanza. Viene utilizzato per calcolare varie quantità, come il numero di moli, la massa e il volume di una sostanza.
| Aspetto | Liquido incolore |
| Peso specifico | 1.22 |
| Colore | Incolore |
| Odore | Acri |
| Massa molare | 46,03 g/mole |
| Densità | 1.220 g/ml |
| Punto di fusione | 8,4°C |
| Punto di ebollizione | 100,8°C |
| Punto flash | 68°C |
| solubilità in acqua | Miscibile |
| Solubilità | Solubile nella maggior parte dei solventi organici |
| Pressione del vapore | 44,5 mmHg |
| Densità del vapore | 1,5 (aria=1) |
| pKa | 3,75 |
| pH | 2.4 |
Sicurezza e pericoli dell’acido formico
HCOOH comporta diversi rischi per la sicurezza e i pericoli. È una sostanza altamente corrosiva e tossica che può causare gravi ustioni alla pelle e danni agli occhi al contatto. L’inalazione di vapori di HCOOH può causare irritazione respiratoria e danni ai polmoni. È anche infiammabile e può accendersi a temperature elevate, presentando pericolo di incendio. È necessario adottare adeguate precauzioni di sicurezza durante la manipolazione di HCOOH, compreso l’uso di indumenti protettivi, guanti e protezione per gli occhi. Dovrebbe essere conservato in un’area fresca, asciutta e ben ventilata, lontano da materiali incompatibili, come agenti ossidanti e alcali.
| Simboli di pericolo | Corrosivo, tossico |
| Descrizione della sicurezza | Indossare guanti protettivi e proteggere gli occhi/il viso. In caso di contatto con gli occhi, immediatamente con abbondante acqua e risciacquare un medico. |
| Numeri di identificazione delle Nazioni Unite | ONU1779 |
| Codice SA | 2915.11.00 |
| Classe di pericolo | 8 (Corrosivo) |
| Gruppo di imballaggio | II (Intermedio) |
| Tossicità | LD50 1,8 g/kg (orale, ratto) |
Metodi per la sintesi dell’acido formico
L’acido formico può essere sintetizzato con vari metodi.
- Un metodo comune prevede la reazione di monossido di carbonio e acqua in presenza di un catalizzatore, come rodio o cobalto. Questo è il processo Formox. Questo processo produce acido formico e idrogeno gassoso.
- Un altro metodo prevede l’ossidazione della formaldeide utilizzando un forte agente ossidante, come l’acido cromico o il permanganato di potassio, in condizioni acide. Questa reazione produce acido formico e acqua.
- Un modo per sintetizzare l’acido formico è far reagire il formiato di sodio con l’acido solforico. Questa reazione porta alla formazione di acido formico e solfato di sodio come sottoprodotto.
- Le formiche producono acido formico come meccanismo di difesa naturale e può essere ottenuto dai loro corpi attraverso la distillazione.
- Un altro metodo per sintetizzare HCOOH prevede la reazione dell’anidride carbonica con l’idrogeno in presenza di un catalizzatore, come cromite di rame o ossido di zinco. Questo processo, noto come reazione di sintesi di HCOOH, produce HCOOH e acqua.
- L’HCOOH può anche essere ottenuto da fonti naturali, come le foglie di ortica, dove è presente in piccole quantità.
Nel complesso, sono disponibili diversi metodi per la sintesi di HCOOH, ciascuno con i suoi vantaggi e svantaggi.
Usi dell’acido formico
L’acido formico ha una vasta gamma di applicazioni in vari settori.
- La sua capacità di prevenire la crescita di microrganismi dannosi rende l’acido formico una scelta comune come agente conservante e antibatterico nei mangimi e negli insilati animali.
- Aiuta a prevenire la crescita di microrganismi dannosi nei mangimi e negli insilati, rendendolo un utile additivo.
- L’industria tessile utilizza l’acido formico come agente di tintura e finitura dei tessuti per migliorare la solidità del colore e aumentare l’affinità dei coloranti con le fibre.
- L’acido formico funge da solvente e intermedio nella produzione di vari prodotti chimici come acido acetico, formammide e metanolo.
- L’acido formico è un agente conciante utilizzato nell’industria della pelle che aiuta a migliorare la consistenza e la durata dei prodotti in pelle.
- Nella produzione della gomma, l’acido formico favorisce il processo di vulcanizzazione fungendo da coagulante.
- L’industria farmaceutica utilizza l’acido formico come conservante per i vaccini e come disinfettante per le apparecchiature mediche.
- Inoltre, l’acido formico trova applicazione nella produzione di vari farmaci, tra cui diuretici e antistaminici.
- L’acido formico è un agente riducente nelle reazioni di sintesi organica e un catalizzatore nelle reazioni di polimerizzazione.
- L’acido formico aiuta a migliorare l’aroma di vari prodotti, rendendolo utile nella produzione di aromi e fragranze.
Nel complesso, la diversità delle applicazioni dell’acido formico in vari settori è dovuta alle sue proprietà uniche e alla sua natura versatile.
Domande:
D. L’acido formico è un acido forte?
R. L’acido formico è un acido debole, con un valore pKa di circa 3,75. Ciò significa che non si dissocia completamente in acqua ed è un acido più debole degli acidi forti come l’acido cloridrico o l’acido solforico.
D. Qual è l’acido formico o acetico più acido?
R. L’acido formico è più acido dell’acido acetico. Ciò è dovuto alla presenza di un gruppo metilico nell’acido acetico che stabilizza la carica negativa sulla base coniugata, rendendola meno probabile che si dissoci. D’altra parte, l’acido formico ha una dimensione molecolare più piccola e un atomo elettronegativo più forte (ossigeno), che ne facilita la dissociazione e lo rende più acido.
D. Quale formica produce l’acido formico?
R. L’acido formico è prodotto da diverse specie di formiche, comprese le formiche del legno, le formiche del fuoco e alcune specie di api senza pungiglione. L’acido viene immagazzinato nel corpo della formica e viene utilizzato come meccanismo di difesa contro i predatori. Quando minacciata, la formica può sparare acido formico dal pungiglione o rilasciarlo da ghiandole specializzate nel suo corpo.
