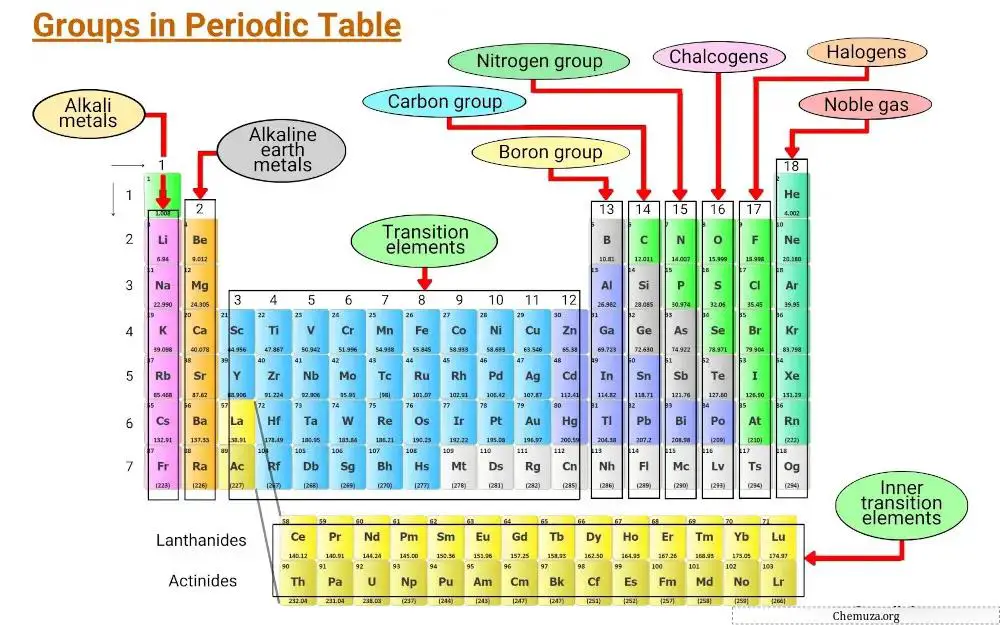
Gli elementi sono raggruppati in base a caratteristiche comuni, comprese le configurazioni elettroniche e il comportamento degli elettroni di valenza.
Le colonne verticali della tavola periodica sono chiamate gruppi e nella tavola periodica ci sono 18 gruppi, ciascuno con il proprio insieme di proprietà che determinano come un elemento interagirà con altri elementi e formerà composti.
In questo articolo esploreremo i diversi gruppi nella tavola periodica.
Andiamo subito al sodo!.
Gruppo 1: Metalli alcalini
Il gruppo 1 della tavola periodica è noto come metalli alcalini .
Questo gruppo comprende litio, sodio, potassio, rubidio, cesio e francio.
I metalli alcalini sono noti per la loro morbidezza, il basso punto di fusione e l’elevata reattività con l’acqua e l’aria.
I metalli alcalini sono molto reattivi perché hanno un solo elettrone nel loro guscio più esterno, a cui cedono facilmente per formare ioni positivi. [1]
Ciò li rende ottimi conduttori di elettricità e utili in molte applicazioni, comprese batterie e processi industriali.
Tuttavia, a causa della loro elevata reattività, i metalli alcalini devono essere maneggiati con cautela. Possono accendersi spontaneamente nell’aria e reagire in modo esplosivo con l’acqua, liberando gas idrogeno. [2]
Gruppo 2: Metalli alcalino terrosi
Il gruppo 2 della tavola periodica è noto come ” metalli alcalino terrosi “. Questo gruppo comprende sei elementi: berillio, magnesio, calcio, stronzio, bario e radio.
Questi metalli sono chiamati “alcalini” perché reagiscono con l’acqua per formare soluzioni alcaline (basiche) .
I metalli alcalino terrosi hanno proprietà simili, inclusi elevati punti di fusione e di ebollizione, basse densità e la capacità di formare facilmente ioni con una carica +2.
Sono anche molto reattivi, soprattutto con l’acqua e l’ossigeno. Tuttavia, a differenza dei metalli alcalini del Gruppo 1, sono meno reattivi e hanno un punto di fusione più elevato.
Questi elementi si trovano in molti oggetti di uso quotidiano, comprese le ossa (calcio), i fuochi d’artificio (stronzio) e le parti di aeroplani (magnesio).
I metalli alcalino terrosi vengono utilizzati anche nei processi industriali, come la produzione di alluminio e acciaio.
Gruppo 3 – 11: Metalli di transizione
Il gruppo da 3 a 11 della tavola periodica è noto come gruppo dei metalli di transizione . Questi metalli hanno caratteristiche uniche che li distinguono dagli altri oggetti sulla tavola.
Una delle caratteristiche distintive dei metalli di transizione è la loro capacità di formare composti colorati.
Ciò è dovuto alle loro configurazioni elettroniche uniche, che consentono loro di assorbire e riflettere determinate lunghezze d’onda della luce. [3]
I metalli di transizione sono noti anche per i loro elevati punti di fusione e di ebollizione, nonché per la loro resistenza e durata.
Sono spesso utilizzati nei materiali da costruzione, nei cavi elettrici e persino nei gioielli.
Gruppo 13: gruppo boro
Il gruppo 13 della tavola periodica è noto come gruppo del boro e comprende gli elementi boro (B), alluminio (Al), gallio (Ga), indio (In), tallio (Tl) e nihonium (Nh).
Questi elementi condividono alcune caratteristiche che li rendono chimicamente simili.
Il boro è l’unico metalloide di questo gruppo, il che significa che ha proprietà sia metalliche che non metalliche .
Gruppo 14: Gruppo del carbonio
Il gruppo 14 della tavola periodica è noto come gruppo del carbonio e comprende carbonio (C), silicio (Si), germanio (Ge), stagno (Sn), piombo (Pb) e flerovio (Fl).
Questi elementi hanno proprietà simili perché hanno tutti quattro elettroni di valenza.
Il carbonio è un elemento molto importante perché costituisce la base di tutte le molecole organiche, compresi gli elementi costitutivi della vita come proteine e DNA. [4]
Gruppo 15: Pnicogeni
Il gruppo 15 della tavola periodica è noto anche come gruppo azoto (o pnictogeni).
Questo gruppo contiene 6 elementi: azoto (N), fosforo (P), arsenico (As), antimonio (Sb), bismuto (Bi) e moscovio (Mc).
Gli elementi del gruppo 15 hanno cinque elettroni di valenza nel loro guscio elettronico più esterno, il che significa che tendono a formare tre legami covalenti per completare il loro ottetto.
Tendono anche a guadagnare tre elettroni per formare anioni . Gli elementi diventano meno non metallici e più metallici nel gruppo.
Gruppo 16: Calcogeni
Il gruppo 16 della tavola periodica è noto come gruppo dell’ossigeno. Comprende gli elementi ossigeno (O), zolfo (S), selenio (Se), tellurio (Te), polonio (Po) ed epatico (Lv).
Questi elementi condividono alcune caratteristiche, tra cui avere sei elettroni di valenza nel loro livello energetico più esterno.
L’ossigeno è l’elemento più abbondante di questo gruppo ed è essenziale per la vita, poiché è un componente chiave dell’acqua e di molte molecole organiche.
Gli elementi del gruppo dell’ossigeno possono formare composti con molti altri elementi, inclusi metalli e non metalli .
Gruppo 17: Alogeni
Il gruppo 17 della tavola periodica è noto anche come gruppo alogeno . È composto da sei elementi: fluoro, cloro, bromo, iodio, astato e tennessina.
Tutti gli alogeni hanno sette elettroni nel loro guscio più esterno, noto anche come guscio di valenza. Ciò li rende molto reattivi, poiché hanno bisogno solo di un elettrone in più per completare il loro guscio esterno e diventare stabili.
Un’altra caratteristica importante degli alogeni è che sono tutti non metalli, ovvero non conducono elettricità e non sono malleabili o duttili come i metalli.
Esistono anche in tutti e tre gli stati della materia a temperatura ambiente, dove il fluoro e il cloro sono gas, il bromo è un liquido e lo iodio e l’astato sono solidi.
Gruppo 18: Gas rari
Il gruppo 18 della tavola periodica è noto anche come gas nobili .
I gas nobili includono elio (He), neon (Ne), argon (Ar), kripton (Kr), xeno (Xe) e radon (Rn).
Questi gas sono detti nobili perché sono molto stabili e non reagiscono facilmente con altri elementi.
I gas nobili si trovano nella colonna più a destra della tavola periodica e hanno tutti un guscio esterno completo di elettroni, il che li rende molto poco reattivi.
Sono inoltre inodori, incolori e hanno bassi punti di ebollizione e di fusione.
