Il glicole etilenico (C2H6O2) è un liquido trasparente, inodore e dal sapore dolce comunemente utilizzato negli antigelo e in altre applicazioni industriali. È tossico una volta ingerito e può causare seri problemi di salute.
| Nome IUPAC | Etano-1,2-diolo |
| Formula molecolare | C2H6O2 |
| numero CAS | 107-21-1 |
| Sinonimi | 1,2-etandiolo, glicole, glicole monoetilenico, MEG, alcol etilene, acido ipodicarbonoso, etilene diidrato |
| InChI | InChI=1S/C2H6O2/c3-1-2-4/h3-4H,1-2H2 |
Proprietà del glicole etilenico
Massa molare del glicole etilenico
Il glicole monoetilenico (MEG) ha una massa molare di 62,07 g/mol. La massa molare è la massa di una mole di una sostanza, espressa in grammi. La massa molare del glicole monoetilenico può essere utilizzata per determinare la quantità di glicole monoetilenico necessaria in un’applicazione specifica, come l’antigelo per un veicolo.
Formula del glicole etilenico
La formula chimica del glicole etilenico è C2H6O2. La formula rappresenta il numero di atomi di ciascun elemento in una molecola di glicole etilenico. La formula del glicole etilenico è importante per determinarne le proprietà, come il punto di ebollizione, il punto di fusione e la densità. La formula può essere utilizzata anche per calcolare la quantità di glicole etilenico necessaria per un’applicazione specifica.
Punto di ebollizione del glicole etilenico
Il glicole monoetilenico ha un punto di ebollizione di 197,3°C (387,1°F) a pressione atmosferica. Il punto di ebollizione è la temperatura alla quale una sostanza passa dallo stato liquido a quello gassoso. L’alto punto di ebollizione del glicole monoetilenico lo rende un efficace refrigerante e antigelo per l’uso in automobili e altre applicazioni.
Punto di fusione del glicole etilenico
Il glicole monoetilenico ha un punto di fusione di -12,9°C (8,8°F). Il punto di fusione è la temperatura alla quale una sostanza passa dallo stato solido a quello liquido. Il basso punto di fusione del glicole monoetilenico gli consente di rimanere liquido a basse temperature, rendendolo un refrigerante efficace per l’uso in climi freddi.
Densità del glicole etilenico g/mL
La densità del glicole monoetilenico è 1,11 g/mL a 20°C (68°F). La densità è la misura della quantità di massa contenuta in un volume specifico. L’elevata densità del glicole monoetilenico lo rende un efficace refrigerante e antigelo per l’uso in automobili e altre applicazioni in cui lo spazio è limitato.
Peso molecolare del glicole etilenico
Il peso molecolare del glicole monoetilenico è 62,07 g/mol. Il peso molecolare è la somma dei pesi atomici di tutti gli atomi presenti in una molecola. Il peso molecolare del glicole monoetilenico è importante per determinare la quantità di glicole monoetilenico necessaria per un’applicazione specifica, come l’antigelo per un veicolo.
Struttura del glicole etilenico
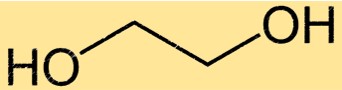
Il glicole monoetilenico ha una struttura chimica semplice costituita da due gruppi idrossilici attaccati a una catena a due atomi di carbonio. La formula molecolare del glicole monoetilenico è C2H6O2 e il suo nome IUPAC è etano-1,2-diolo. La struttura semplice del glicole monoetilenico lo rende un efficace solvente e antigelo da utilizzare in una varietà di applicazioni.
| Aspetto | Liquido limpido e inodore |
| Peso specifico | 1.113 a 20°C |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 62,07 g/mole |
| Densità | 1,11 g/cm³ |
| Punto di fusione | -12,9°C (8,8°F) |
| Punto di ebollizione | 197,3°C (387,1°F) |
| Punto flash | 111°C (232°F) |
| solubilità in acqua | Miscibile |
| Solubilità | Solubile in acetone, alcoli, benzene ed etere |
| Pressione del vapore | 0,08 mmHg a 25°C |
| Densità del vapore | 2.14 (aria = 1) |
| pKa | 14.0 (primo), 13.2 (secondo) |
| pH | Neutro |
Sicurezza e pericoli del glicole etilenico
Sebbene il glicole monoetilenico abbia molte applicazioni pratiche, comporta anche numerosi rischi per la salute umana e l’ambiente. Il glicole monoetilenico è altamente tossico se ingerito e può causare seri problemi di salute, tra cui insufficienza renale e persino la morte. L’inalazione di vapori di glicole monoetilenico può causare irritazione delle vie respiratorie e del sistema nervoso centrale. Anche il glicole monoetilenico è infiammabile e può reagire violentemente con alcune sostanze chimiche. Deve quindi essere maneggiato con cura e conservato correttamente. Inoltre, il glicole monoetilenico è dannoso per la vita acquatica e non deve essere rilasciato nei corsi d’acqua o nell’ambiente. È necessario adottare misure di sicurezza adeguate durante la manipolazione del glicole monoetilenico per evitare incidenti e proteggere la salute umana e l’ambiente.
| Simboli di pericolo | Teschio e ossa incrociate, corrosivo |
| Descrizione della sicurezza | Non ingerire. Evitare il contatto con la pelle e gli occhi. Utilizzare con ventilazione adeguata. Indossare guanti e occhiali protettivi. |
| Numeri di identificazione delle Nazioni Unite | ONU 3082 |
| Codice SA | 2905.32.00 |
| Classe di pericolo | 6.1 (tossico) |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico se ingerito. Può causare insufficienza renale e altri gravi problemi di salute. L’inalazione di vapori può causare irritazione delle vie respiratorie ed effetti sul sistema nervoso centrale. |
Metodi per la sintesi del glicole etilenico
Esistono diversi metodi per sintetizzare il glicole monoetilenico, elemento chiave in molti processi industriali.
Un metodo comune è l’idratazione catalitica dell’ossido di etilene , che prevede la reazione dell’ossido di etilene con acqua in presenza di un catalizzatore, come un acido forte o un ossido metallico.
Un altro metodo consiste nell’idrolizzare il carbonato di etilene, che si forma facendo reagire l’ossido di etilene con l’anidride carbonica.
Un altro modo per sintetizzare il glicole monoetilenico è ossidare l’etilene. Il processo utilizza un catalizzatore di ossido d’argento per ossidare l’etilene, producendo ossido di etilene , che viene poi sottoposto a idrolisi per produrre glicole monoetilenico.
Per sintetizzare il glicole monoetilenico, l’acido ossalico può essere ridotto con idrogeno, con conseguente produzione di acido glicolico. Successivamente, la disidratazione dell’acido glicolico forma glicole monoetilenico.
Usi del glicole etilenico
Il glicole monoetilenico ha molte applicazioni industriali e commerciali, grazie alle sue proprietà uniche e alla sua versatilità. Alcuni dei suoi usi principali includono:
- Antigelo: utilizzato come refrigerante e antigelo nelle applicazioni automobilistiche e industriali. Il suo basso punto di congelamento e l’alto punto di ebollizione lo rendono la scelta ideale per prevenire danni al motore dovuti al congelamento o al surriscaldamento.
- Agente antighiaccio: utilizzato come agente antighiaccio per aerei, strade e marciapiedi, grazie alla sua capacità di abbassare il punto di congelamento dell’acqua.
- Solvente: un solvente molto efficace per un’ampia gamma di sostanze, tra cui resine, oli e coloranti. I produttori lo utilizzano comunemente nella produzione di vernici, rivestimenti e adesivi.
- Umettante: utilizzato come umettante nell’industria cosmetica e della cura personale per aiutare a prevenire la perdita di umidità in prodotti come lozioni e shampoo.
- Intermedio chimico: utilizzato come intermedio chiave nella produzione di un’ampia gamma di prodotti chimici, tra cui fibre e pellicole di poliestere, poliuretani e plastificanti.
- Fluido per il trasferimento di calore: utilizzato come fluido per il trasferimento di calore in varie applicazioni industriali, inclusi sistemi HVAC, collettori solari e sistemi geotermici.
Domande:
D: Cos’è il glicole etilenico?
R: Il glicole monoetilenico è un liquido trasparente, incolore, inodore e dal sapore dolce, comunemente utilizzato come refrigerante e antigelo nelle applicazioni automobilistiche e industriali. Viene anche utilizzato come solvente, umettante e intermedio chimico in vari settori.
D: Qual è la pressione di vapore del glicole etilenico al suo normale punto di ebollizione?
R: La pressione di vapore del glicole monoetilenico al suo normale punto di ebollizione di 197,3°C (387,1°F) è 0,00131 atm.
D: Il glicole etilenico è polare?
R: Sì, il glicole monoetilenico è una molecola polare a causa della presenza di due gruppi funzionali -OH, che creano un momento dipolare e gli consentono di dissolversi in solventi polari.
D: Come misurare il pH del glicole etilenico?
R: Il pH del glicole monoetilenico può essere misurato utilizzando un pHmetro o strisce indicatrici di pH appositamente progettate per l’uso con solventi non acquosi. È importante notare che il glicole monoetilenico non è una sostanza neutra, ma piuttosto un acido debole con un pH intorno a 6,5.
D: In che modo il glicole etilenico influisce sul corpo?
R: Il glicole monoetilenico può essere tossico se ingerito o assorbito attraverso la pelle perché viene metabolizzato dal fegato in sottoprodotti tossici che possono causare insufficienza renale, convulsioni e persino la morte. I sintomi di avvelenamento da glicole monoetilenico comprendono mal di testa, vertigini, nausea, vomito e confusione.
D: Quale formula rappresenta l’1,2-etandiolo?
R: La formula dell’1,2-etandiolo, noto anche come glicole monoetilenico, è C2H6O2.
D: Quali sono le proiezioni di Newman per l’1,2-etandiolo?
R: Le proiezioni di Newman per l’1,2-etandiolo mostrano due conformazioni spostate, con i gruppi -OH orientati in una posizione eclissata o sfalsata l’uno rispetto all’altro.
