Il fosgene è un gas tossico utilizzato nei processi industriali e in guerra. L’inalazione comporta gravi rischi per la salute, provoca danni respiratori e può essere fatale.
| Nome IUPAC | Dicloruro di carbonile |
| Formula molecolare | COCl2 |
| numero CAS | 75-44-5 |
| Sinonimi | Bicloruro carbonico, gas fosgene, cloruro di carbonile |
| InChI | InChI=1S/CCl2O/c2-1(3)4 |
Proprietà del fosgene
Formula del fosgene
La formula chimica del fosgene o del dicloruro di carbonio è COCl2. È costituito da un atomo di carbonio (C), un atomo di ossigeno (O) e due atomi di cloro (Cl). Questa composizione molecolare è essenziale per comprenderne le proprietà e le reazioni.
Massa molare del fosgene
La massa molare del dicloruro di carbonio è di circa 98,92 g/mol. Si calcola sommando le masse atomiche dei suoi costituenti, che sono carbonio (12,01 g/mol), ossigeno (16,00 g/mol) e cloro (35,45 g/mol ciascuno).
Punto di ebollizione del fosgene
Il bicloruro carbonico ha un punto di ebollizione relativamente basso di circa -23,3°C (-9,94°F). A questa temperatura passa dallo stato liquido allo stato gassoso, fondamentale per la sua applicazione in vari processi industriali.
Punto di fusione del fosgene
Il punto di fusione dell’anidride carbonica è piuttosto basso, intorno a -118,3°C (-180,94°F). A questa temperatura, la forma solida del dicloruro di carbonio si trasforma in un liquido. Comprendere questa proprietà è importante per gestire in sicurezza il cloruro di carbonio.
Densità del fosgene g/mL
Il dicloruro carbonico ha una densità di circa 1,432 g/mL a temperatura ambiente (25°C o 77°F). Questa proprietà è fondamentale nel determinare il suo comportamento e le interazioni con altre sostanze.
Peso molecolare del fosgene
Il peso molecolare del dicloruro di carbonio è 98,92 g/mol. Questo valore è vitale per vari calcoli in chimica, inclusa la stechiometria e la determinazione della quantità di dicloruro di carbonio necessaria per le reazioni.
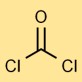
Struttura del fosgene
Il bicloruro carbonico ha una struttura molecolare lineare, in cui l’atomo di carbonio è doppiamente legato all’atomo di ossigeno e legato singolarmente a ciascun atomo di cloro. Questa disposizione influisce sulla sua reattività e stabilità.
Solubilità del fosgene
Il bicloruro carbonico è scarsamente solubile in acqua, con solo una piccola quantità di gas che si dissolve nel liquido. Tuttavia, può reagire con l’acqua per produrre acido cloridrico e anidride carbonica, rendendolo pericoloso in ambienti acquosi.
Comprendere queste proprietà del dicloruro di carbonio è essenziale per maneggiare e utilizzare in sicurezza la sostanza chimica nelle applicazioni industriali e in altri ambienti. È necessario prendere sempre le dovute precauzioni quando si maneggia questo composto tossico e reattivo per prevenire incidenti e rischi per la salute.
| Aspetto | Gas incolore |
| Peso specifico | 3.428 (gas) |
| Colore | N / A |
| Odore | Soffocante, pungente |
| Massa molare | 98,92 g/mole |
| Densità | 1.432 g/ml (liquido) |
| Punto di fusione | -118,3°C (-180,94°F) |
| Punto di ebollizione | -23,3°C (-9,94°F) |
| Punto flash | N / A |
| solubilità in acqua | Reagisce con l’acqua |
| Solubilità | Reagisce con l’acqua per produrre acido cloridrico e anidride carbonica |
| Pressione del vapore | 736 mmHg (25°C) |
| Densità del vapore | 2,98 (aria = 1) |
| pKa | N / A |
| pH | N / A |
Queste proprietà fisico-chimiche forniscono informazioni essenziali sul dicloruro di carbonio, facilitandone la manipolazione sicura e comprendendone il comportamento in vari ambienti.
Sicurezza e pericoli del fosgene
Il cloruro carbonico presenta notevoli rischi per la sicurezza a causa della sua natura tossica e reattiva. Quando si maneggia il cloruro di carbonio, indossare dispositivi di protezione individuale (DPI) adeguati, tra cui protezione respiratoria, guanti e protezione per gli occhi. Garantire un’adeguata ventilazione nelle aree di lavoro per evitare l’esposizione per inalazione. Evitare il contatto con la pelle e gli occhi poiché ciò potrebbe causare gravi irritazioni e ustioni. Il gas dicloruro di carbonio non ha odore, il che lo rende difficile da rilevare. I dispositivi di monitoraggio sono quindi cruciali. In caso di esposizione, consultare immediatamente un medico. Conservare e trasportare il cloruro di carbonio in modo sicuro, secondo le normative e le migliori pratiche. Comprenderne i pericoli è essenziale per prevenire gli incidenti e proteggere sia la salute umana che l’ambiente.
| Simboli di pericolo | Teschio e ossa incrociate |
| Descrizione della sicurezza | Gas altamente tossico. Maneggiare con estrema cautela. Utilizzare DPI adeguati. Evitare l’inalazione e il contatto con la pelle. |
| Numeri di identificazione delle Nazioni Unite | UN1076 |
| Codice SA | 2812.10.0000 |
| Classe di pericolo | 2.3 (Gas tossico) |
| Gruppo di imballaggio | IO |
| Tossicità | Il fosgene è altamente tossico e può essere fatale per inalazione o contatto con la pelle. Utilizzare misure di sicurezza rigorose. |
Comprendere gli aspetti di rischio e sicurezza del dicloruro di carbonio è fondamentale per una manipolazione sicura e la prevenzione degli incidenti. È altamente tossico e comporta rischi significativi per la salute, rendendo essenziali procedure e precauzioni di sicurezza adeguate.
Metodi di sintesi del fosgene
Diversi metodi consentono la sintesi del dicloruro di carbonio.
Un approccio comune è il “processo Deacon”, in cui il cloro gassoso reagisce con il monossido di carbonio a temperature elevate in presenza di un catalizzatore adatto come il cloruro di rame (II) . Un altro metodo prevede la “clorazione diretta” del monossido di carbonio con cloro gassoso, facilitata da cloruri di ferro o altri metalli come catalizzatori.
La produzione di dicloruro di carbonio comporta la “carbonilazione ossidativa” del cloruro di metilene o del cloruro di metile, utilizzando ossigeno e un catalizzatore metallico come il cloruro rameoso. Un altro metodo per sintetizzare il dicloruro di carbonio è la “via dell’urea”, che genera dicloruro di carbonio come sottoprodotto durante la produzione di urea.
È però fondamentale notare che il cloruro di carbonio è una sostanza molto pericolosa e la sua sintesi richiede la massima cura e competenza. I lavoratori devono eseguire questi processi in ambienti industriali ben controllati con rigorose misure di sicurezza e dispositivi di protezione per evitare l’esposizione a gas tossici e garantire la loro sicurezza e quella dell’ambiente.
Usi del fosgene
Il cloruro carbonico ha varie applicazioni industriali grazie alle sue proprietà uniche, ma è importante notare che i suoi usi devono essere gestiti con estrema cautela a causa della sua natura tossica. Ecco alcuni dei suoi usi:
- Intermedi chimici: il bicloruro carbonico aiuta a produrre diverse sostanze chimiche essenziali, inclusi gli isocianati, che svolgono un ruolo essenziale nella produzione di schiume poliuretaniche, rivestimenti e adesivi.
- Produzione di pesticidi: il dicloruro di carbonio facilita la sintesi di alcuni pesticidi ed erbicidi, contribuendo così alla protezione delle colture e al controllo dei parassiti.
- Produzione di policarbonato: l’anidride carbonica è un componente cruciale nella produzione di plastica in policarbonato, utilizzata in un’ampia gamma di prodotti, dagli occhiali alle bottiglie d’acqua.
- Industria tessile: il bicloruro carbonico è coinvolto nella produzione di coloranti specifici e altri prodotti chimici utilizzati nell’industria tessile.
- Produzione di schiuma: l’anidride carbonica svolge un ruolo chiave nella produzione di materiali in schiuma, compresi alcuni tipi di schiuma utilizzati nell’isolamento.
- Prodotti farmaceutici: il dicloruro carbonico agisce come intermedio chimico nella produzione di alcuni prodotti farmaceutici.
- Ricerca di laboratorio: i ricercatori a volte utilizzano il cloruro di carbonio negli esperimenti di laboratorio.
- Produzione di gomma sintetica: l’anidride carbonica è parte integrante della produzione di alcune gomme sintetiche.
- Purificazione dell’acqua: in precedenza il bicloruro carbonico veniva utilizzato in piccole quantità per la purificazione dell’acqua, ma oggigiorno per questo scopo vengono più comunemente utilizzate alternative più sicure.
Sebbene il bicloruro di carbonio abbia importanti usi industriali, la sua elevata tossicità e le sue proprietà pericolose richiedono rigorose misure di sicurezza durante la manipolazione, lo stoccaggio e il trasporto per prevenire incidenti e garantire il benessere dei lavoratori e delle persone. l’ambiente.
Domande:
D: Cosa fa il gas fosgene a una persona?
R: Il gas dicloruro di carbonio può causare lesioni respiratorie, con conseguente difficoltà di respirazione ed edema polmonare potenzialmente fatale.
D: Cos’è il fosgene?
R: L’anidride carbonica è un composto chimico altamente tossico utilizzato in vari processi industriali.
D: Cos’è il gas fosgene?
R: Il gas dicloruro di carbonio è la forma gassosa del composto chimico, noto per i suoi effetti soffocanti e tossici sul sistema respiratorio.
D: Cosa fa il fosgene al corpo?
R: L’anidride carbonica può danneggiare i polmoni, causando accumulo di liquidi e gravi difficoltà respiratorie.
D: Con quale frequenza Grignard reagirà con il fosgene?
R: Il reagente di Grignard reagisce con il bicloruro di carbonio una sola volta, formando un chetone.
D: Quale organo umano viene attaccato dal cloro gassoso e dal fosgene?
R: I gas di cloro e dicloruro di carbonio attaccano principalmente i polmoni.
D: In che modo il gas fosgene ti uccide?
R: Il gas dicloruro di carbonio provoca grave irritazione polmonare, portando all’accumulo di liquidi e al soffocamento.
D: Chi ha inventato il gas fosgene?
R: L’anidride carbonica fu scoperta dal chimico britannico John Davy nel 1812.
D: Effetti del gas dicloruro di carbonio?
R: Il gas dicloruro di carbonio può causare danni respiratori, edema polmonare e, nei casi più gravi, la morte.
D: Struttura di Lewis dell’anidride carbonica?
R: La struttura di Lewis del dicloruro carbonico è costituita da un carbonio doppiamente legato all’ossigeno e da un legame singolo a due atomi di cloro.
D: Gas dicloruro di carbonio della prima guerra mondiale?
R: Il dicloruro di carbonio venne utilizzato come arma chimica durante la prima guerra mondiale, causando effetti devastanti sui soldati.
D: Quando è stato utilizzato per la prima volta il gas fosgene?
R: Il gas dicloruro di carbonio fu utilizzato per la prima volta come arma chimica durante la prima guerra mondiale nel 1915.
D: Da dove viene il fosgene?
R: L’anidride carbonica viene solitamente prodotta facendo reagire il cloro con il monossido di carbonio o altri composti contenenti carbonio.
