Il fosfato trisodico (Na3PO4) è un composto composto da ioni sodio e fosfato. Ha vari usi in settori come quello alimentare, farmaceutico e dei detergenti, per la sua capacità di controllare l’acidità e fungere da tampone.
| Nome IUPAC | Fosfato di sodio |
| Formula molecolare | Na3PO4 |
| numero CAS | 7601-54-9 |
| Sinonimi | fosfato di sodio, TSP, ortofosfato di sodio, fosfato di sodio tribasico, fosfato di sodio terziario, ortofosfato trisodico |
| InChI | InChI=1S/3Na.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
Proprietà del fosfato trisodico
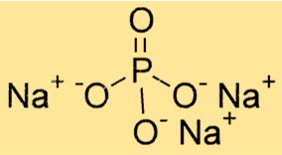
Formula di fosfato trisodico
La formula chimica del fosfato trisodico è Na3PO4. È costituito da tre cationi sodio (Na+) e un anione fosfato (PO43-). La formula è importante per determinare la stechiometria delle reazioni chimiche e per calcolare la quantità di una sostanza in una determinata quantità.
Massa molare del fosfato trisodico
La massa molare di Na3PO4 è 163,94 g/mol. Si calcola sommando le masse atomiche dei suoi elementi costitutivi, che sono sodio, fosforo e ossigeno. La massa molare è un parametro importante utilizzato per determinare la quantità di una sostanza presente in una determinata quantità. Viene anche utilizzato per calcolare la stechiometria delle reazioni chimiche.
Fosfato trisodico Punto di ebollizione
Il punto di ebollizione di Na3PO4 è 1587°C. Questa è la temperatura alla quale lo stato liquido passa allo stato gassoso. Il punto di ebollizione di una sostanza dipende da vari fattori, come pressione, temperatura e forze intermolecolari. L’alto punto di ebollizione di Na3PO4 è dovuto alla sua natura ionica e alle forti forze intermolecolari.
Punto di fusione del fosfato trisodico
Il punto di fusione di Na3PO4 è 1340°C. Questa è la temperatura alla quale una sostanza solida passa allo stato liquido. Il punto di fusione di una sostanza dipende da vari fattori, come pressione, temperatura e forze intermolecolari. L’alto punto di fusione di Na3PO4 è dovuto alla sua natura ionica e alle forti forze intermolecolari.
Fosfato trisodico Densità g/ml
La densità di Na3PO4 è 2,54 g/ml. La densità è la misura della massa di una sostanza per unità di volume. È un’importante proprietà fisica di una sostanza utilizzata per determinarne la massa o il volume. L’elevata densità di Na3PO4 è dovuta alla sua natura ionica e alle particelle fitte.
Peso molecolare del fosfato trisodico
Il peso molecolare di Na3PO4 è 163,94 g/mol. È la somma dei pesi atomici di tutti gli atomi di una molecola. Il peso molecolare di Na3PO4 è importante per determinare la stechiometria delle reazioni chimiche e per calcolare la quantità di una sostanza in una determinata quantità.
Struttura del fosfato trisodico
Na3PO4 ha una struttura cristallina con una disposizione esagonale di atomi strettamente ravvicinati. I cationi sodio si trovano negli interstizi degli anioni compatti dell’ossigeno. L’anione fosfato è costituito da un atomo di fosforo e quattro atomi di ossigeno, disposti in forma tetraedrica.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 2.536 g/cm3 |
| Colore | Da incolore a bianco |
| Odore | Inodore |
| Massa molare | 163,94 g/mole |
| Densità | 2,54 g/ml |
| Punto di fusione | 1340°C |
| Punto di ebollizione | 1.587°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in acqua e insolubile nei solventi organici |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | pKa1 = 2,15, pKa2 = 7,20, pKa3 = 12,35 |
| pH | pH della soluzione 0,1 M = 11,5 |
Sicurezza e pericoli del fosfato trisodico
Na3PO4 è generalmente considerato sicuro per l’uso negli alimenti, nei prodotti farmaceutici e in altre applicazioni. Tuttavia, come qualsiasi sostanza chimica, può rappresentare un pericolo se maneggiata in modo improprio. L’ingestione di grandi quantità di Na3PO4 può portare a problemi gastrointestinali come diarrea, nausea e vomito. Il contatto degli occhi e della pelle con la sostanza può causare irritazioni e ustioni. È importante maneggiare Na3PO4 con cura, indossare dispositivi di protezione individuale adeguati e seguire tutte le procedure di sicurezza quando si lavora con questa sostanza. In caso di ingestione o esposizione accidentale consultare immediatamente un medico.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Utilizzare con ventilazione adeguata. Evitare il contatto con la pelle e gli occhi. Indossare dispositivi di protezione. |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 28352200 |
| Classe di pericolo | Non classificato come pericoloso |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità. L’ingestione di grandi quantità può causare problemi gastrointestinali. Può causare irritazioni e ustioni a contatto con la pelle e gli occhi. |
Metodi per la sintesi del fosfato trisodico
Esistono diversi metodi per sintetizzare Na3PO4, inclusa la reazione dell’idrossido di sodio con acido fosforico , la reazione del carbonato di sodio con acido fosforico e la reazione del cloruro di sodio con acido fosforico in presenza di carbonato di sodio.
Un metodo comune prevede la reazione dell’idrossido di sodio (NaOH) con l’acido fosforico (H3PO4) . Questa reazione produce Na3PO4 (Na3PO4) e acqua (H2O). L’equazione chimica bilanciata per questa reazione è:
3 NaOH + H3PO4 → Na3PO4 + 3 H2O
Un altro metodo prevede la reazione del carbonato di sodio (Na2CO3) con l’acido fosforico (H3PO4) . Questa reazione produce Na3PO4 (Na3PO4), anidride carbonica (CO2) e acqua (H2O). L’equazione chimica bilanciata per questa reazione è:
Na2CO3 + 2 H3PO4 → 2 Na3PO4 + 3 CO2 + 3 H2O
Un terzo metodo prevede la reazione del cloruro di sodio (NaCl) con l’acido fosforico (H3PO4) in presenza di carbonato di sodio (Na2CO3) . Questa reazione produce Na3PO4 (Na3PO4), cloruro di sodio (NaCl), anidride carbonica (CO2) e acqua (H2O). L’equazione chimica bilanciata per questa reazione è:
3 NaCl + H3PO4 + Na2CO3 → Na3PO4 + 3 NaCl + 3 CO2 + 3 H2O
Le industrie utilizzano ampiamente questi metodi per produrre Na3PO4 per varie applicazioni.
Usi del fosfato trisodico
Na3PO4 ha molti usi in vari settori grazie alle sue proprietà uniche. Alcuni usi comuni di Na3PO4 sono:
- Industria alimentare: utilizzato come additivo alimentare per migliorare la consistenza, il sapore e la durata di conservazione dei prodotti alimentari trasformati.
- Industria farmaceutica: utilizzata nella produzione di vari prodotti farmaceutici, inclusi lassativi, antiacidi e soluzioni elettrolitiche.
- Trattamento dell’acqua: utilizzato nei processi di trattamento dell’acqua per controllare la formazione di calcare e prevenire la corrosione nei sistemi di distribuzione dell’acqua.
- Industria dei detergenti: utilizzato nella produzione di detergenti per migliorarne le proprietà detergenti.
- Agricoltura: utilizzato come fertilizzante e ammendante in agricoltura per fornire nutrienti essenziali alle piante.
- Applicazioni industriali: utilizzato in vari processi industriali tra cui il trattamento superficiale dei metalli, la produzione di ceramica e come ritardante di fiamma.
- Applicazioni di laboratorio: utilizzato in varie applicazioni di laboratorio tra cui purificazione di DNA e proteine, soluzioni tampone e come regolatore del pH.
Domande:
D: Na3PO4 è solubile in acqua?
R: Sì, Na3PO4 è altamente solubile in acqua.
D: Qual è la concentrazione molare degli ioni sodio in una soluzione 0,350 M di Na3PO4?
R: In una soluzione Na3PO4 0,350 M, la concentrazione molare degli ioni sodio è 1,05 M.
D: Na3PO4 è un acido o una base?
R: Na3PO4 è un sale basico.
D: Qual è l’equazione ionica netta per la reazione tra soluzioni acquose di Na3PO4 e CuSO4?
R: L’equazione ionica netta per la reazione tra soluzioni acquose di Na3PO4 e CuSO4 è: 2Na+(aq) + Cu2+(aq) + 2PO43-(aq) + SO42-(aq) → Cu3(PO4)2(s) + 2Na+ (aq) + SO42-(aq).
D: Quale volume di una soluzione di Na3PO4 3,50 M dovresti utilizzare per preparare 1,50 L di una soluzione di Na3PO4 2,55 M?
R: Per preparare una soluzione di Na3PO4 2,55 M utilizzando una soluzione di Na3PO4 3,50 M, dovrai utilizzare 0,921 L della soluzione 3,50 M.
D: Cos’è il fosfato trisodico?
R: Il fosfato trisodico è un sale inorganico di fosfato di sodio con la formula chimica Na3PO4.
D: Il fosfato trisodico è solubile?
R: Sì, il fosfato trisodico è altamente solubile in acqua.
D: Come fai a sapere se la tua polvere bianca è bicarbonato di sodio o fosfato trisodico?
R: Un modo per differenziare il bicarbonato di sodio da Na3PO4 è eseguire un semplice test del pH. Il bicarbonato di sodio è basico e darà un pH superiore a 7, mentre Na3PO4 è neutro e darà un pH pari a 7.
D: Qual è la formula del fosfato trisodico?
R: La formula del fosfato trisodico è Na3PO4.
