Il fosfato di potassio (K3PO4) è un composto che contiene gli elementi potassio e fosforo. È comunemente usato come additivo alimentare e fertilizzante grazie alla sua elevata solubilità e capacità di fornire nutrienti essenziali per la crescita delle piante.
| Nome dell’IUPAC | Fosfato di potassio |
| Formula molecolare | K3PO4 |
| numero CAS | 7778-53-2 |
| Sinonimi | Fosfato tripotassico, ortofosfato di potassio, fosfato terziario di potassio, monofosfato tripotassico, fosfato tribasico di potassio |
| InChI | InChI=1S/3K.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
Proprietà del fosfato di potassio
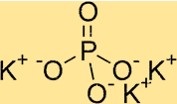
Formula di fosfato di potassio
La formula chimica del fosfato di potassio è K3PO4. Ciò indica che il composto contiene tre ioni K+ e uno ione PO43- in ciascuna unità della formula. La formula del fosfato di potassio è utile per determinare la stechiometria delle reazioni che coinvolgono il composto, nonché per identificare la quantità di ciascun elemento presente in una data massa del composto.
Massa molare del fosfato di potassio
La massa molare di K3PO4 è 212,27 g/mol. Si calcola sommando al composto le masse atomiche di potassio, fosforo e ossigeno. La massa molare è un parametro importante per determinare la quantità di sostanza presente in una data massa del composto. È utile anche per calcolare la stechiometria delle reazioni che coinvolgono K3PO4.
Punto di ebollizione del fosfato di potassio
Il punto di ebollizione di K3PO4 è 1660°C. Questo alto punto di ebollizione è dovuto ai forti legami ionici tra gli ioni K+ e gli ioni PO43- nel composto. È anche un’indicazione della stabilità del composto alle alte temperature. Il punto di ebollizione di K3PO4 è utile in varie applicazioni industriali, come nella produzione di ceramica e vetro.
Punto di fusione del fosfato di potassio
Il punto di fusione di K3PO4 è 1340°C. Questa è la temperatura alla quale il composto solido passa allo stato liquido. L’alto punto di fusione del K3PO4 è dovuto alla natura ionica del composto, che richiede una grande quantità di energia per superare le forze di attrazione tra gli ioni. Il punto di fusione del K3PO4 è utile per determinarne l’idoneità per varie applicazioni, come la produzione di fertilizzanti e additivi alimentari.
Densità del fosfato di potassio g/mL
La densità di K3PO4 è 2,564 g/mL a temperatura ambiente. L’elevata densità del composto è dovuta alla presenza di tre ioni K+ e uno ione PO43- in ciascuna unità della formula. La densità di K3PO4 è utile per determinarne la solubilità e il comportamento in vari processi industriali, come nella produzione di fertilizzanti e additivi alimentari.
Peso molecolare del fosfato di potassio
Il peso molecolare di K3PO4 è 212,27 g/mol. È la somma dei pesi atomici di tutti gli atomi presenti nel composto. Il peso molecolare è utile per calcolare la quantità di sostanza presente in una data massa del composto, nonché per determinare la stechiometria delle reazioni che coinvolgono K3PO4.
Struttura del fosfato di potassio
K3PO4 ha una struttura cristallina ortorombica. È costituito da un insieme di tetraedri PO4, in cui ciascuno ione fosfato condivide due atomi di ossigeno con gli ioni fosfato vicini. Gli ioni potassio si trovano tra i tetraedri fosfato, circondati da atomi di ossigeno. La struttura di K3PO4 è utile per comprenderne le proprietà, come la solubilità e la stabilità termica.
| Aspetto | Polvere cristallina bianca |
| Densità specifica | 2.564 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 212,27 g/mole |
| Densità | 2.564 g/ml |
| Punto di fusione | 1340°C |
| Punto di ebollizione | 1660°C |
| Punto flash | Non applicabile |
| solubilità in acqua | 100 g/l (20°C) |
| Solubilità | Solubile in etanolo e acetone, insolubile in etere |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | pKa1 = 2,16, pKa2 = 7,21, pKa3 = 12,32 |
| pH | Il pH di una soluzione all’1% è 11,5 |
Sicurezza e pericoli del fosfato di potassio
K3PO4 è generalmente considerato sicuro da usare se maneggiato correttamente. Tuttavia, come qualsiasi sostanza chimica, può rappresentare un pericolo se maneggiata in modo improprio o ingerita in grandi quantità. Il composto è classificato come irritante per la pelle, gli occhi e le vie respiratorie e può causare gravi ustioni o difficoltà respiratorie se inalato o ingerito in alte concentrazioni. È inoltre incompatibile con acidi e agenti ossidanti e può provocare incendi o esplosioni se esposto a questi materiali. Pertanto, è importante maneggiare K3PO4 con cautela, indossare dispositivi di protezione adeguati e conservarlo in un’area fresca, asciutta e ben ventilata, lontano da sostanze incompatibili.
| Simboli di pericolo | Xi (irritante) |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. |
| Numeri di identificazione delle Nazioni Unite | ONU 2833 (per anidro), ONU 2423 (per triidrato) |
| Codice SA | 28352400 |
| Classe di pericolo | 6.1 (tossico) |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto): 2.340 mg/kg; LC50 (inalazione, ratto): 50 mg/L |
Metodi per la sintesi del fosfato di potassio (K3PO4)
Esistono diversi metodi per sintetizzare K3PO4, inclusa la reazione dell’acido fosforico (H3PO4) con idrossido di potassio (KOH) o la decomposizione termica di KH2PO4.
Un metodo prevede la reazione di quantità equimolari di KOH e H3PO4 in acqua a una temperatura compresa tra circa 60 e 80°C. La procedura prevede l’evaporazione della miscela risultante e il riscaldamento del residuo solido a circa 300°C per produrre K3PO4.
Un altro metodo consiste nel far reagire KH2PO4 con KOH ad alta temperatura (superiore a 400°C) per produrre K3PO4 e acqua. Un forno specializzato può eseguire questo processo chiamato decomposizione termica.
La reazione dell’acido fosforico con carbonato di potassio (K2CO3) e la reazione dell’ossido di potassio (K2O) con anidride fosforica (P2O5) sono ulteriori metodi per produrre K3PO4.
Usi del fosfato di potassio
K3PO4 ha diversi usi pratici in una vasta gamma di settori, tra cui:
- Fertilizzante: comunemente usato come fertilizzante grazie al suo alto contenuto di fosforo. Gli agricoltori spesso lo aggiungono al terreno per fornire nutrienti essenziali alle piante.
- Industria alimentare: utilizzato come additivo alimentare per regolare i livelli di acidità, prevenire lo scolorimento e migliorare la consistenza.
- Agente tampone: varie applicazioni di laboratorio lo utilizzano come agente tampone efficace, comprese le soluzioni tampone per la calibrazione del pH e la ricerca biologica.
- Detergenti: utilizzato nella produzione di detersivi e prodotti per la pulizia grazie alla sua capacità di addolcire l’acqua e prevenire l’accumulo di depositi minerali.
- Medicina: utilizzato come integratore alimentare per il trattamento di determinate condizioni mediche, come bassi livelli di fosfato nel sangue.
- Trattamento dell’acqua: utilizzato nel trattamento dell’acqua per prevenire la formazione di incrostazioni e corrosione nei tubi e nelle apparecchiature.
- Ritardante di fiamma: utilizzato come ritardante di fiamma in vari materiali, inclusi tessuti e plastica, grazie alla sua capacità di rilasciare vapore acqueo e prevenire la propagazione delle fiamme.
Domande:
D: Il fosfato di potassio è solubile in acqua?
R: Sì, K3PO4 è solubile in acqua.
D: Quanti ioni potassio sono necessari per legarsi a uno ione fosfato?
R: Sono necessari tre ioni potassio per legarsi a uno ione fosfato, formando K3PO4.
D: Che precipitato si forma quando si mescolano soluzioni acquose di bromuro di calcio e fosfato di potassio?
R: Quando si miscelano soluzioni acquose di bromuro di calcio e K3PO4, si forma un precipitato di fosfato di calcio (Ca3(PO4)2).
D: Il k3po4 è solubile in acqua?
R: Sì, K3PO4 è solubile in acqua.
D: Il k3po4 è solubile?
R: Sì, K3PO4 è solubile in acqua.
D: Quali prodotti risultano dalla miscelazione di soluzioni acquose di Ni(C2H3O2)2 (aq) e K3PO4 (aq)?
R: Quando si mescolano soluzioni acquose di Ni(C2H3O2)2 e K3PO4, si forma un precipitato di fosfato di nichel (II) (Ni3(PO4)2), così come soluzioni acquose di acetato di potassio (KCH3COO) e acido acetico (CH3COOH).
D: Quale elemento aumenta il suo numero di ossidazione in questa reazione? 3KOH + H3PO4 → K3PO4 + 3H2O
R: L’elemento fosforo aumenta il suo numero di ossidazione da +5 in H3PO4 a +5 in K3PO4.
D: Cos’è K3PO4?
R: K3PO4 è la formula chimica del fosfato di potassio, un composto utilizzato in varie applicazioni, come fertilizzanti, additivi alimentari e prodotti per la pulizia.
