Il fluoruro di sodio (NaF) è un composto chimico utilizzato per prevenire la carie. Rafforza lo smalto dei denti rimineralizzandolo e inibisce la crescita di batteri orali nocivi.
| Nome dell’IUPAC | Fluoruro di sodio |
| Formula molecolare | NaF |
| numero CAS | 7681-49-4 |
| Sinonimi | Monofluoruro di sodio, Fluoruro di sodio anidro, Fluoruro monosodico, Fluoruro di sodio, |
| Solutia SFL, Fluka 01178, 3M ESPE 12104, Puriss. fluoruro di sodio, fluoruro di sodio extrapuro | |
| InChI | InChI=1S/FH.Na/h1H;/q;+1/p-1 |
Proprietà del fluoruro di sodio
Formula di fluoruro di sodio
La formula chimica del fluoruro di sodio è NaF. Ciò significa che ogni molecola di NaF è costituita da uno ione Na+ e uno ione F-. La formula è importante in chimica perché fornisce informazioni sui tipi e sul numero di atomi o ioni presenti in una molecola di una sostanza.
Massa molare del fluoruro di sodio
La massa molare di NaF è 41,99 g/mol. È la somma delle masse atomiche di un atomo di sodio e di un atomo di fluoro, che sono rispettivamente 22,99 g/mol e 19,00 g/mol. La massa molare è una proprietà importante in chimica perché consente di calcolare il numero di moli di una sostanza in base alla sua massa e viceversa.
Punto di ebollizione del fluoruro di sodio
Il punto di ebollizione del NaF è 1705°C (3101°F). Questa è la temperatura alla quale la forma liquida di NaF passa alla forma gassosa. NaF ha un punto di ebollizione relativamente alto rispetto ad altri composti F a causa del suo forte legame ionico tra ioni Na+ e ioni F-.
Punto di fusione del fluoruro di sodio
Il punto di fusione del NaF è 993°C (1.819°F). Questa è la temperatura alla quale la forma solida di NaF passa alla forma liquida. NaF ha un punto di fusione relativamente alto a causa del suo forte legame ionico tra ioni Na+ e ioni F-.
Densità del fluoruro di sodio g/mL
La densità di NaF è 2,79 g/mL. Ciò significa che un millilitro di NaF pesa 2,79 grammi. La densità è una proprietà importante di una sostanza perché può essere utilizzata per determinare la massa di una sostanza in base al suo volume, o il volume di una sostanza in base alla sua massa.
Peso molecolare del fluoruro di sodio
Il peso molecolare di NaF è 41,99 g/mol. È la somma dei pesi atomici di sodio e fluoro in una molecola di NaF. Il peso molecolare è importante in chimica perché aiuta a calcolare varie proprietà di una sostanza, come la sua densità e molarità.
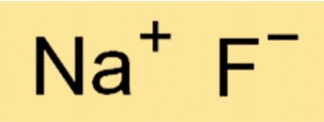
Struttura del fluoruro di sodio
NaF ha una struttura cristallina nella sua forma solida. È costituito da ioni Na+ e ioni F- disposti in una struttura reticolare cubica. Gli ioni Na+ occupano gli angoli del cubo, mentre gli ioni fluoruro occupano i centri delle facce del cubo. Questa disposizione si traduce in un forte legame ionico tra gli ioni Na+ e gli ioni F-.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2,79 g/cm³ |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 41,99 g/mole |
| Densità | 2,79 g/ml |
| Punto di fusione | 993°C (1.819°F) |
| Punto di ebollizione | 1705°C (3101°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | 4,24 g/100 ml (20°C) |
| Solubilità | Solubile in alcool ed etere |
| Pressione del vapore | 1 mmHg (713°C) |
| Densità del vapore | 2,9 (aria = 1) |
| pKa | 7.2 |
| pH | 7,6-8,4 (soluzione acquosa 0,1 M) |
Sicurezza e pericoli del fluoruro di sodio
NaF presenta alcuni problemi di sicurezza e pericolo. È tossico se ingerito in grandi quantità e può causare nausea, vomito, diarrea e dolori addominali. L’inalazione di polvere di NaF può causare irritazione respiratoria e danni ai polmoni. Può anche causare irritazione agli occhi e alla pelle al contatto. Il NaF è inoltre corrosivo per alcuni metalli e può reagire violentemente con acidi forti. Quando si lavora con NaF è necessario seguire le corrette procedure di manipolazione, stoccaggio e smaltimento per evitare questi pericoli. È importante indossare sempre dispositivi di protezione individuale adeguati durante la manipolazione del NaF.
| Simboli di pericolo | T, N |
| Descrizione della sicurezza | Evitare l’ingestione, l’inalazione, il contatto con la pelle e gli occhi. Indossare DPI adeguati. Seguire procedure sicure di manipolazione, stoccaggio e smaltimento. |
| Numeri di identificazione delle Nazioni Unite | UN1690 (per solido) |
| Codice SA | 2826.12.00 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | II |
| Tossicità | Tossico se ingerito o inalato in grandi quantità. Può causare irritazione alle vie respiratorie, agli occhi e alla pelle. Corrosivo per alcuni metalli. |
Metodi per la sintesi del fluoruro di sodio
I chimici utilizzano diversi metodi per sintetizzare il fluoruro di sodio (NaF).
Un metodo comune consiste nel far reagire l’acido fluoridrico con idrossido di sodio o carbonato di sodio . Per rimuovere eventuale acqua o impurità, qualcuno asciuga e riscalda il prodotto risultante.
Un altro metodo prevede la reazione di NaCl con HF , che produce NaF e acido cloridrico come sottoprodotti. Questo metodo è meno comune a causa di problemi di sicurezza associati alla manipolazione del fluoruro di idrogeno.
Un altro modo per sintetizzare NaF è far reagire il carbonato di sodio con il gas HF . La reazione produce NaF, anidride carbonica e vapore acqueo. Le applicazioni industriali utilizzano comunemente questo metodo per produrre NaF.
Inoltre, il NaF può essere sintetizzato riscaldando il fluoro gassoso con sodio metallico. Tuttavia, questo metodo è raro a causa dell’elevata reattività di sodio e fluoro. Inoltre, questo metodo richiede attrezzature specializzate e un’attenta manipolazione a causa del rischio di esplosione.
Usi del fluoruro di sodio
NaF ha molteplici utilizzi in diversi settori. Ecco alcuni usi comuni di NaF:
- Igiene dentale: dentifricio, collutori e trattamenti dentistici aggiungono NaF per prevenire la carie dentale e migliorare la salute orale.
- Trattamento dell’acqua: aggiunto all’acqua potabile in alcune aree per prevenire la carie.
- Applicazioni industriali: utilizzato come flusso nella produzione di alluminio e nella produzione di vetro e ceramica per abbassare il punto di fusione e migliorare la trasparenza.
- Metallurgia: Utilizzato nella raffinazione e nella lavorazione dei metalli, ad esempio per la rimozione delle impurità nella produzione di acciaio e alluminio.
- Antiparassitario: utilizzato come antiparassitario nella lotta contro roditori e insetti.
- Chimica: utilizzato come fonte di ioni fluoruro in varie reazioni chimiche.
- Industria nucleare: utilizzato come refrigerante e agente di trasferimento del calore in alcuni reattori nucleari.
- Prodotti farmaceutici: utilizzati nella produzione di alcuni farmaci, come antidepressivi e antinfiammatori.
Domande:
D: Il fluoruro di sodio contenuto nel dentifricio è dannoso per la salute?
R: Il NaF presente nel dentifricio è generalmente considerato sicuro se usato come indicato. Aiuta a prevenire la carie ed è approvato dalle associazioni dentistiche di tutto il mondo. Tuttavia, un consumo eccessivo di dentifricio può causare disturbi di stomaco e altri problemi di salute.
D: Una soluzione diluita o concentrata di fluoruro di sodio avrebbe un punto di ebollizione più alto?
R: Una soluzione concentrata di NaF avrebbe un punto di ebollizione più alto rispetto ad una soluzione diluita a causa del maggior numero di particelle di soluto nella soluzione, che aumenta il punto di ebollizione attraverso l’effetto di aumento del punto di ebollizione.
D: Quanti grammi ci sono in 4,5 moli di fluoruro di sodio?
R: La massa molare di NaF è 41,99 g/mol, quindi 4,5 moli di NaF equivarrebbero a 188,96 grammi.
D: Il fluoruro di sodio è ionico o covalente?
R: NaF è un composto ionico, formato dall’attrazione elettrostatica tra lo ione Na+ e lo ione F-.
D: Qual è il modo corretto di rappresentare il composto ionico fluoruro di sodio?
R: Il modo corretto per rappresentare questo composto ionico è NaF, dove Na rappresenta Na+ e F rappresenta F-.
D: Qual è il nome del composto con la formula NaF?
R: Il nome del composto con la formula NaF è fluoruro di sodio.
D: NaF è un acido o una base?
R: NaF è un sale formato dalla reazione di neutralizzazione tra una base forte (idrossido di sodio) e un acido debole (acido fluoridrico). Non è né un acido né una base, ma può subire idrolisi per formare una soluzione basica.
