Il fluoruro di rame (CuF2) è un composto costituito da rame e fluoro. Presenta un colore blu-verdastro e trova applicazioni in vari settori, tra cui l’elettronica e la catalisi.
| Nome IUPAC | Fluoruro di rame(II). |
| Formula molecolare | CuF2 |
| numero CAS | 7789-19-7 |
| Sinonimi | Fluoruro rameico, Difluoruro di rame |
| InChI | InChI=1S/2FH.Cu/h2*1H;/q;;+2/p-2 |
Proprietà del fluoruro di rame
Formula del fluoruro di rame
La formula del difluoruro di rame è CuF2. È costituito da un atomo di rame (Cu) e due atomi di fluoro (F). Questo composto ionico forma una struttura cristallina stabile a causa dell’attrazione elettrostatica tra lo ione rame caricato positivamente e gli ioni fluoruro caricati negativamente.
Massa molare del fluoruro di rame
La massa molare del difluoruro di rame (CuF2) si calcola sommando le masse atomiche dei suoi elementi costitutivi. Il rame ha una massa molare di circa 63,55 g/mol e il fluoro ha una massa molare di circa 18,99 g/mol. Sommandoli insieme, otteniamo che la massa molare del difluoruro di rame è di circa 101,09 g/mol.
Punto di ebollizione del fluoruro di rame
Il difluoruro di rame non ha un punto di ebollizione ben definito, perché subisce una decomposizione prima di raggiungere il punto di ebollizione. A temperature elevate, il difluoruro di rame inizia a decomporsi in difluoruro di rame (CuF) e fluoro gassoso (F2). Pertanto, è considerato termicamente instabile.
Punto di fusione del fluoruro di rame
Il difluoruro di rame ha un punto di fusione di circa 840°C (1544°F). A questa temperatura, i cristalli solidi di difluoruro di rame assorbono energia sufficiente per passare allo stato fuso, consentendone l’utilizzo in una varietà di applicazioni ad alta temperatura.
Densità del fluoruro di rame g/mL
La densità del difluoruro di rame è di circa 4,23 g/mL. Questo valore di densità indica che il difluoruro di rame è un materiale relativamente denso, che può essere utile in applicazioni specifiche in cui è richiesta un’elevata densità.
Peso molecolare del fluoruro di rame
Il peso molecolare del difluoruro di rame (CuF2) è di circa 101,09 g/mol. Si calcola sommando i pesi atomici del rame e dei due atomi di fluoro presenti nella formula.
Struttura del fluoruro di rame
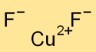
Il difluoruro di rame adotta una struttura cristallina, formando una disposizione a rete di cationi Cu2+ e anioni F-. I cationi rame sono circondati da sei ioni fluoruro e ciascuno ione fluoruro è in contatto con tre ioni rame.
Solubilità del fluoruro di rame
Il difluoruro di rame ha una bassa solubilità in acqua. Forma sali poco solubili che rilasciano ioni Cu2+ e F- nella soluzione. Questa proprietà è importante in vari processi e applicazioni chimici, comprese la sintesi inorganica e le applicazioni elettrochimiche.
| Aspetto | Solido blu verdastro |
| Peso specifico | 4,23 g/ml |
| Colore | blu verdastro |
| Odore | Inodore |
| Massa molare | 101,09 g/mole |
| Densità | 4,23 g/cm³ |
| Punto di fusione | 840°C (1544°F) |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Debole, forma sali poco solubili |
| Solubilità | Scarsamente solubile |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non applicabile |
| pH | Neutro |
Sicurezza e pericoli del fluoruro di rame
Il difluoruro di rame solleva diverse considerazioni sulla sicurezza e sui rischi. Il contatto diretto con il composto può causare irritazione alla pelle e agli occhi. L’inalazione delle sue polveri o dei suoi fumi può causare problemi respiratori. Se riscaldato, può rilasciare gas di fluoro tossico, dannoso se inalato. Pertanto, durante la manipolazione del difluoruro di rame è necessario utilizzare una ventilazione adeguata e dispositivi di protezione individuale. Inoltre, è essenziale evitare l’ingestione poiché può causare disturbi gastrointestinali. Il composto deve essere conservato in contenitori sigillati, lontano da materiali incompatibili per evitare reazioni. Protocolli di sicurezza e pratiche di manipolazione adeguati sono essenziali per ridurre al minimo i rischi associati al difluoruro di rame.
| Simboli di pericolo | Irritante |
| Descrizione della sicurezza | Provoca irritazione alla pelle e agli occhi. Nocivo se inalato. Può rilasciare gas di fluoro tossico quando riscaldato. Evitare di ingerire. Utilizzare un’adeguata ventilazione e dispositivi di protezione. |
| Numeri di identificazione delle Nazioni Unite | N / A |
| Codice SA | 2826.92.00 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | III |
| Tossicità | Tossico |
Metodi di sintesi del fluoruro di rame
Esistono vari metodi per sintetizzare il difluoruro di rame. Un approccio comune consiste nell’aggiungere ossido di rame (CuO) o carbonato di rame (CuCO3) in un contenitore e mescolare attentamente mentre si aggiunge acido fluoridrico (HF) al contenitore. La reazione continua, producendo difluoruro di rame e acqua come sottoprodotti.
Un altro metodo prevede la reazione del rame metallico o della polvere di rame con fluoro gassoso (F2) ad alte temperature. Questo processo richiede un’attenta gestione a causa della reattività del fluoro gassoso. Forma direttamente difluoruro di rame attraverso la combinazione di atomi di rame e fluoro.
Inoltre, la preparazione del difluoruro di rame può avvenire facendo reagire il cloruro di rame (II) (CuCl2) con fluoruro di sodio (NaF) in una soluzione acquosa. La reazione produce difluoruro di rame e cloruro di sodio come sottoprodotto.
Questi metodi di sintesi richiedono misure di sicurezza e attrezzature adeguate a causa della reattività di alcune delle sostanze chimiche coinvolte. Il controllo preciso delle condizioni di reazione è fondamentale per ottenere rese elevate di difluoruro di rame puro.
Usi del fluoruro di rame
Il difluoruro di rame trova una gamma di preziose applicazioni grazie alle sue proprietà e caratteristiche uniche. Ecco alcuni usi chiave:
- Elettronica: il difluoruro di rame viene utilizzato nell’industria dei semiconduttori come fonte di ioni rame per i processi di deposizione di film sottili. È pioniere nella produzione di dispositivi elettronici e circuiti integrati.
- Catalisi: agisce come catalizzatore in varie reazioni chimiche, inclusa la sintesi di composti organici e in processi industriali come le reazioni di fluorurazione.
- Fonte di fluoro: il difluoruro di rame viene utilizzato per produrre gas fluoro (F2) mediante decomposizione ad alta temperatura, che è essenziale per varie applicazioni industriali.
- Ceramica e vetro: il composto viene utilizzato come additivo nella produzione di ceramica e vetro per modificare le proprietà del materiale e migliorarne le prestazioni.
- Materiali dentali: il difluoruro di rame è incorporato nei prodotti dentali, come dentifrici e collutori, per migliorarne le proprietà anticarie e antibatteriche.
- Rivestimenti: viene utilizzato in rivestimenti speciali, come rivestimenti antiriflesso per dispositivi ottici e rivestimenti protettivi per superfici metalliche.
- Ritardanti di fiamma: il difluoruro di rame viene utilizzato come additivo nei materiali ritardanti di fiamma, contribuendo a ridurre l’infiammabilità di vari prodotti.
- Reagente chimico: nei laboratori e nella ricerca, il difluoruro di rame viene utilizzato come reagente in reazioni e analisi chimiche specifiche.
La versatilità del difluoruro di rame lo rende prezioso in tutti i settori, dall’elettronica alla sanità, dove le sue proprietà uniche vengono sfruttate per migliorare le prestazioni e la sicurezza. Tuttavia, una corretta manipolazione e precauzioni di sicurezza sono essenziali a causa della sua reattività e dei potenziali pericoli.
Domande:
D: Qual è la formula di massa del fluoruro di rame(II)?
R: La massa formula del difluoruro di rame(II) (CuF2) è di circa 101,09 g/mol.
D: Quale delle seguenti è la formula corretta per il fluoruro di rame (II)?
R: La formula corretta per il difluoruro di rame(II) è CuF2.
D: Il rame pulisce il fluoro?
R: No, il rame non pulisce il difluoruro. Il rame non ha la capacità di rimuovere il difluoruro dall’acqua.
D: Qual è il composto covalente di NaCl, KCl, CuF2 e CF4?
R: Il composto covalente è CF4 (tetrafluoruro di carbonio).
D: Quando una soluzione acquosa di CuF2 viene elettrolizzata, cosa si forma agli elettrodi?
R: All’anodo si forma ossigeno gassoso (O2) e al catodo rame metallico (Cu).
D: Qual è il nome di CuF2 nel sistema Stock?
R: Il nome CuF2 nel sistema Stock è difluoruro di rame (II).
D: Qual è la carica dello ione rame nel composto CuF2?
R: La carica dello ione rame in CuF2 è +2.
D: Il CuF2 è ionico o molecolare?
R: CuF2 è un composto ionico.
D: Qual è la carica del composto ionico CuF2?
R: Il composto ionico CuF2 è neutro.
D: Qual è il nome del composto con la formula CuF2?
R: Il nome del composto con la formula CuF2 è difluoruro di rame (II).
