Il nitrato di ferro III è un composto chimico. Si forma combinando ioni ferro con ioni nitrato. È comunemente usato in applicazioni industriali e come reagente di laboratorio.
| Nome IUPAC | Nitrato di ferro (III). |
| Formula molecolare | Fe(NO3)3 |
| numero CAS | 10421-48-4 |
| Sinonimi | Nitrato ferrico, trinitrato di ferro, sale di ferro (III) dell’acido nitrico |
| InChI | InChI=1S/Fe.3NO3/c;3 2-1(3)4/q+3;3 -1 |
Proprietà del nitrato di ferro (III).
Formula del nitrato di ferro (III).
La formula del nitrato di ferro III è Fe(NO3)3. È costituito da uno ione ferro (Fe) e tre ioni nitrato (NO3). Questa formula rappresenta la combinazione del catione ferro con gli anioni nitrato.
Massa molare del nitrato di ferro (III).
La massa molare del nitrato di ferro può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il ferro (Fe) ha una massa molare di 55,845 g/mol, mentre ciascuno ione nitrato (NO3) ha una massa molare di 62,0049 g/mol. Sommando questi valori si ottiene una massa molare di circa 241,86 g/mol per il nitrato di ferro.
Punto di ebollizione del nitrato di ferro (III).
Il nitrato di ferro non ha un punto di ebollizione specifico. Quando riscaldato, si decompone in vari ossidi di azoto e alla fine forma ossido di ferro. La temperatura di decomposizione dipende da fattori quali la concentrazione e la presenza di altre sostanze.
Punto di fusione del nitrato di ferro (III).
Il punto di fusione del nitrato di ferro è di circa 47°C (117°F). A questa temperatura il composto solido si trasforma nello stato liquido. È importante notare che il punto di fusione può variare leggermente a seconda di fattori come le impurità o l’esatta composizione del composto.
Densità dei nitrati di ferro(III) g/mL
La densità di Fe(NO3)3 è di circa 1,68 g/mL. La densità rappresenta la massa per unità di volume di una sostanza. In questo caso indica la massa di Fe(NO3)3 per millilitro di composto.
Peso molecolare del nitrato di ferro (III).
Il peso molecolare del nitrato di ferro è di circa 241,86 g/mol. Il peso molecolare si riferisce alla somma dei pesi atomici di tutti gli atomi presenti in una molecola.
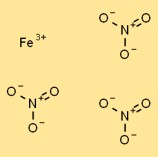
Struttura del nitrato di ferro (III).
Il nitrato di ferro ha una struttura cristallina nella sua forma solida. È costituito da cationi Fe3+ circondati da anioni nitrato coordinati (NO3-). I cationi ferro sono tenuti insieme da legami ionici, mentre gli anioni nitrato sono attratti dai cationi da forze elettrostatiche.
Solubilità dei nitrati di ferro(III).
Il nitrato di ferro è molto solubile in acqua. Si dissolve facilmente in acqua per formare una soluzione limpida, di colore giallo pallido. La solubilità del nitrato di ferro in altri solventi o sostanze può variare.
| Aspetto | Cristalli giallo pallido |
| Peso specifico | 1,68 |
| Colore | Giallo pallido |
| Odore | Inodore |
| Massa molare | 241,86 g/mole |
| Densità | 1,68 g/ml |
| Punto di fusione | 47°C (117°F) |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in acqua e solventi polari |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Acido |
Sicurezza e pericoli del nitrato di ferro (III).
Il nitrato di ferro presenta alcuni rischi per la sicurezza e occorre prestare attenzione quando lo si maneggia. È considerato irritante per la pelle, gli occhi e il sistema respiratorio. Evitare il contatto diretto con il composto e indossare dispositivi di protezione come guanti e occhiali. L’ingestione o l’inalazione del nitrato di ferro può causare effetti dannosi e pertanto non deve essere ingerito o inalato. È importante lavorare con questo composto in un’area ben ventilata per ridurre al minimo il rischio di inalazione. In caso di esposizione o ingestione accidentale, è necessario consultare immediatamente un medico. Per garantire la sicurezza è necessario seguire pratiche di stoccaggio e manipolazione adeguate.
| Simboli di pericolo | Xi,O |
| Descrizione della sicurezza | Provoca irritazione alla pelle e agli occhi. Può causare irritazione respiratoria. Nocivo se ingerito. |
| Numeri di identificazione delle Nazioni Unite | ONU 1466 (Anidro) |
| Codice SA | 28342990 |
| Classe di pericolo | 5.1 (Agente ossidante) |
| Gruppo di imballaggio | II |
| Tossicità | Tossicità moderata |
Metodi per la sintesi del nitrato di ferro (III).
Il nitrato di ferro può essere sintetizzato con vari metodi, il metodo comune è quello di sciogliere l’ossido di ferro (III) (Fe2O3) in acido nitrico concentrato (HNO3). Questa reazione porta alla formazione di nitrato di ferro, rappresentato dall’equazione:
L’acido nitrico concentrato dissolve l’ossido di ferro (III) , producendo Fe (NO3)3 oltre a produrre acqua:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O.
Un altro metodo prevede la combinazione del ferro metallico con una miscela di acido nitrico e perossido di idrogeno, che ossida il ferro per formare nitrato di ferro. Questa reazione ben nota merita il nome di metodo “acqua regia”.
L’aggiunta di ferro metallico a una miscela di acido nitrico e perossido di idrogeno porta alla produzione di nitrato di ferro e acqua:
2Fe + 8HNO3 + 6H2O2 → 2Fe(NO3)3 + 6H2O.
È fondamentale prestare attenzione quando si eseguono queste reazioni a causa della natura corrosiva e ossidante delle sostanze chimiche coinvolte. È necessario seguire adeguate misure di sicurezza, come indossare indumenti protettivi e lavorare in un’area ben ventilata.
Rinomati fornitori di prodotti chimici offrono nitrato di ferro disponibile in commercio, garantendo una fonte coerente e affidabile del composto per varie applicazioni nelle industrie e nei laboratori.
Usi del nitrato di ferro (III).
Il nitrato di ferro ha diversi usi pratici in varie industrie e laboratori. Ecco alcune applicazioni chiave del nitrato di ferro:
- Catalizzatore industriale: diversi processi industriali, inclusa la produzione di nylon e altri polimeri, utilizzano il nitrato di ferro come catalizzatore.
- Tintura e pigmenti: l’industria della tintura e della pigmentazione utilizza il nitrato di ferro come mordente per fissare i coloranti sui tessuti e migliorare la solidità del colore.
- Mordenzante: le industrie della lavorazione dei metalli e dell’elettronica utilizzano il nitrato di ferro come mordenzante per creare modelli e disegni complessi su superfici metalliche.
- Reagente di laboratorio: il nitrato di ferro funge da comune reagente di laboratorio per varie reazioni chimiche ed esperimenti, in particolare per la sintesi di altri composti.
- Agente ossidante: il nitrato di ferro agisce come un agente ossidante nelle reazioni chimiche, inclusa la sintesi organica, grazie alle sue forti proprietà ossidanti.
- Trattamento dell’acqua: il nitrato di ferro è utile nei processi di trattamento dell’acqua per rimuovere le impurità, come fosfati e solfuri, dalle acque reflue industriali.
- Fotografia: alcuni processi fotografici, in particolare la preparazione di emulsioni fotografiche a base di ferro, utilizzano nitrato di ferro.
- Chimica analitica: il nitrato di ferro trova applicazioni nelle tecniche di chimica analitica, come l’analisi colorimetrica, per rilevare e quantificare sostanze specifiche.
- Conservazione del legno: i trattamenti di conservazione del legno utilizzano il nitrato di ferro come ingrediente attivo per proteggere il legno dalla putrefazione fungina e dalle infestazioni di insetti.
- Applicazioni farmaceutiche: la formulazione di alcuni prodotti farmaceutici e medicinali prevede l’uso di nitrato di ferro.
È importante notare che è necessario seguire una corretta manipolazione e precauzioni di sicurezza quando si lavora con il nitrato di ferro a causa della sua natura corrosiva e ossidante.
Domande:
D: Il nitrato di ferro (III) è infiammabile?
R: No, il nitrato di ferro non è infiammabile.
D: Quali sono i problemi di sicurezza e di gestione del nitrato di ferro (III)?
R: I problemi di sicurezza includono l’irritazione della pelle, degli occhi e del tratto respiratorio. Deve quindi essere maneggiato con adeguati dispositivi di protezione e precauzioni.
D: Quale formula rappresenta il nitrato di ferro (III)?
R: La formula del nitrato di ferro è Fe(NO3)3.
D: Qual è la formula del nitrato di ferro (III)?
R: La formula del nitrato di ferro(III) è Fe(NO3)3.
D: Qual è la massa molare del nitrato di ferro (III)?
R: La massa molare di Fe(NO3)3 è circa 241,86 g/mol.
D: L’idrossido di ferro è solubile in acqua?
R: L’idrossido di ferro è scarsamente solubile in acqua.
D: Reagisce con il nitrato di ferro (III)?
R: No, il calcio (Ca) generalmente non reagisce con Fe(NO3)3.
D: Con quale parte dell’aspirina reagisce il nitrato di ferro (III)?
R: Il nitrato di ferro (III) reagisce con il gruppo carbossilato (-COO-) presente nella molecola di aspirina.
D: Qual è la massa molecolare del nitrato di ferro (III)?
R: La massa molecolare di Fe(NO3)3 è di circa 241,86 g/mol.
D: L’Al reagisce con il nitrato di ferro (III)?
R: Sì, l’alluminio (Al) può reagire con Fe(NO3)3 per formare nitrato di alluminio e ferro metallico.
D: Quante moli di nitrato sono sciolte in 50,0 g di acqua in una soluzione di nitrato di ferro (III) 3,80 M?
R: Per determinare le moli di nitrato è necessario il volume della soluzione, poiché vengono fornite solo la molarità e la massa dell’acqua.
