L’idrossido di ferro (III) è un composto formato dalla reazione del ferro con l’acqua. È comunemente usato nei prodotti farmaceutici, nel trattamento delle acque e come pigmento nelle vernici.
| Nome IUPAC | Idrossido di ferro (III). |
| Formula molecolare | Fe(OH)₃ |
| numero CAS | 20344-49-4 |
| Sinonimi | Idrossido di ferro, triidrossido di ferro, idrato di ferro, ossiidrossido di ferro (III). |
| InChI | InChI=1S/Fe.3H2O/h;3*1H2/q+3;;;/p-3 |
Proprietà dell’idrossido di ferro (III).
Formula dell’idrossido di ferro (III).
La formula dell’idrossido di ferro(III) è Fe(OH)₃. Ciò indica che ciascuna molecola di Fe(OH)₃ è costituita da un atomo di Fe legato a tre ioni OH.
Massa molare dell’idrossido di ferro (III).
La massa molare di Fe(OH)₃ può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il ferro ha una massa molare di 55,845 g/mol e ciascuno ione idrossido (OH) ha una massa molare di 17,007 g/mol. Pertanto, la massa molare di Fe(OH)₃ è di circa 106,867 g/mol.
Punto di ebollizione dell’idrossido di ferro (III).
Fe(OH)₃ non ha un punto di ebollizione ben definito poiché si decompone prima di raggiungere il punto di ebollizione. Invece, subisce una decomposizione termica per formare ossido di ferro (III) e acqua quando riscaldato.
Punto di fusione dell’idrossido di ferro (III).
Anche Fe(OH)₃ si decompone per riscaldamento e non ha un punto di fusione distinto. Si trasforma in ossido di ferro (III) e acqua ad alte temperature.
Densità dell’idrossido di ferro (III) g/mL
La densità di Fe(OH)₃ dipende da vari fattori come il suo stato fisico (solido o soluzione) e la sua concentrazione. La densità di una forma solida di Fe(OH)₃ è di circa 3,4 g/mL.
Peso molecolare dell’idrossido di ferro (III).
Il peso molecolare di Fe(OH)₃ viene calcolato sommando i pesi atomici dei suoi atomi costituenti. Il peso molecolare di Fe(OH)₃ è di circa 106,867 g/mol.
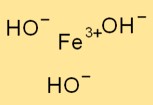
Struttura dell’idrossido di ferro (III).
Fe(OH)₃ adotta una struttura trigonale, dove un atomo di ferro è circondato da tre ioni idrossido. L’atomo di ferro funge da atomo centrale e gli ioni idrossido sono legati ad esso tramite legami ionici.
Solubilità dell’idrossido di ferro (III).
Fe(OH)₃ ha una solubilità limitata in acqua. Forma un precipitato quando disciolto in acqua e la sua solubilità dipende da vari fattori come la temperatura, il pH e la presenza di altri ioni. La solubilità di Fe(OH)₃ aumenta in condizioni acide.
| Aspetto | Marrone solido |
| Peso specifico | 3.4 |
| Colore | Marrone |
| Odore | Inodore |
| Massa molare | 106,867 g/mole |
| Densità | 3,4 g/ml |
| Punto di fusione | Decomposto |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Insolubile |
| Solubilità | Insolubile. Dipende da fattori come la temperatura, il pH e la presenza di altri ioni |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Circa 5-7 |
Sicurezza e pericoli dell’idrossido di ferro (III).
Fe(OH)₃ pone alcune considerazioni e pericoli sulla sicurezza. È generalmente considerato di bassa tossicità. Tuttavia, l’ingestione o l’inalazione di grandi quantità può causare irritazione gastrointestinale e disturbi respiratori. È importante evitare il contatto con gli occhi e la pelle poiché ciò potrebbe causare irritazioni. In caso di contatto, sciacquare le zone interessate con abbondante acqua. Quando si maneggia Fe(OH)₃, è consigliabile indossare dispositivi di protezione adeguati, come guanti e occhiali, per ridurre al minimo il rischio di esposizione. Deve essere garantita un’adeguata ventilazione per evitare l’accumulo di polvere. Inoltre, è essenziale seguire le precauzioni di sicurezza e maneggiare Fe(OH)₃ con cautela per ridurre al minimo i rischi potenziali.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | – Evitare il contatto con gli occhi e la pelle <br> – Indossare dispositivi di protezione <br> – Garantire una ventilazione adeguata |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 2821.10.0000 |
| Classe di pericolo | Non classificato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità |
Metodi per la sintesi dell’idrossido di ferro (III).
Esistono diversi metodi per sintetizzare Fe(OH)₃. Un metodo comunemente utilizzato prevede la reazione di precipitazione tra un sale di ferro e una base. Ad esempio, aggiungendo una soluzione di cloruro di ferro (FeCl₃) ad una soluzione di idrossido di sodio (NaOH) , si può formare Fe(OH)₃. La reazione avviene come segue:
FeCl₃ + 3NaOH → Fe(OH)₃ + 3NaCl
In un altro metodo, l’idrossido di ferro(II) può essere ossidato a Fe(OH)₃ esponendolo all’aria o trattandolo con un agente ossidante. La reazione avviene come segue:
4Fe(OH)₂ + O₂ → 2Fe(OH)₃
Inoltre, Fe(OH)₃ può essere preparato idrolizzando una soluzione di sale di ferro. Questo processo prevede l’aggiunta di acqua alla soluzione del sale di ferro, con conseguente formazione di un precipitato di Fe(OH)₃. La reazione avviene come segue:
FeCl₃ + 3H₂O → Fe(OH)₃ + 3HCl
Questi metodi di sintesi forniscono modi per ottenere Fe(OH)₃ per varie applicazioni, tra cui prodotti farmaceutici, trattamento delle acque e come pigmento nelle vernici. È importante seguire adeguate precauzioni di sicurezza e gestire le sostanze chimiche in modo responsabile durante il processo di sintesi.
Usi dell’idrossido di ferro (III).
Fe(OH)₃ ha diverse applicazioni grazie alle sue proprietà uniche. Ecco alcuni usi comuni di Fe(OH)₃:
- Industria farmaceutica: l’industria farmaceutica utilizza Fe(OH)₃ nella produzione di integratori e farmaci di ferro, come quelli usati per trattare l’anemia da carenza di ferro.
- Trattamento dell’acqua: i processi di trattamento dell’acqua utilizzano Fe(OH)₃ per rimuovere contaminanti e impurità. Fe(OH)₃ agisce come un flocculante, aiutando ad agglomerare e rimuovere le particelle sospese nell’acqua.
- Pigmento nelle vernici: Fe(OH)₃, con il suo colore marrone, trova applicazione come pigmento in vernici, rivestimenti e coloranti. Conferisce una gamma di toni terrosi ed è particolarmente utile per produrre colori ocra e terra di Siena.
- Trattamento delle acque reflue: gli impianti di trattamento delle acque reflue utilizzano Fe(OH)₃ per rimuovere fosfati e contaminanti di metalli pesanti dalle acque reflue industriali.
- Catalisi: Fe(OH)₃ agisce come catalizzatore in varie reazioni chimiche, inclusa la decomposizione del perossido di idrogeno e le reazioni di ossidazione.
- Adsorbente: Fe(OH)₃ funge da materiale adsorbente per rimuovere impurità, contaminanti e coloranti dalle soluzioni.
- Ammendante del suolo: Fe(OH)₃ agisce come ammendante del suolo per migliorare la fertilità del suolo e la disponibilità di nutrienti. Migliora la capacità di trattenere i nutrienti del terreno e fornisce ferro essenziale per la crescita delle piante.
- Reagente di laboratorio: in laboratorio, ricercatori e analisti utilizzano Fe(OH)₃ come reagente per una varietà di scopi analitici e di ricerca, comprese le reazioni di precipitazione e la regolazione del pH.
Le versatili applicazioni di Fe(OH)₃ evidenziano la sua importanza in diversi settori e il suo contributo a vari processi che vanno dai prodotti farmaceutici alla igiene ambientale.
Domande:
D: Qual è il peso corretto per la formula dell’idrossido di ferro (III)?
R: Il peso corretto della formula per Fe(OH)₃ è circa 106,867 g/mol.
D: Qual è l’equazione ionica completa per la reazione tra FeBr3 e idrossido di bario?
R: L’equazione ionica completa per la reazione tra FeBr3 e idrossido di bario è FeBr₃ + 3Ba(OH)₂ → 3BaBr₂ + Fe(OH)₃.
D: Quale massa di precipitato di idrossido di ferro(III) può essere prodotta facendo reagire 75,0 ml?
R: Per determinare la massa del precipitato Fe(OH)₃ sono necessarie informazioni aggiuntive come la concentrazione o la molarità dei reagenti.
D: Come si forma l’idrossido di ferro (III)?
R: Fe(OH)₃ può essere formato mediante una varietà di metodi, comprese reazioni di precipitazione tra sali e basi di ferro, ossidazione di Fe(OH)2 o idrolisi di una soluzione di sali di ferro.
D: L’idrossido di ferro (III) è solubile?
R: No, Fe(OH)₃ non è solubile in acqua. Forma un precipitato quando sciolto in acqua.
D: Quanti grammi di Fe(OH)₃ ci sono in 4,61 grammi di Fe³⁺?
R: Per determinare i grammi di Fe(OH)₃ sono necessarie la massa molare di Fe³⁺ e la stechiometria della reazione.
D: Di che colore è Fe(OH)₃?
R: Fe(OH)₃ è generalmente di colore marrone.
D: L’idrossido di ferro è un solido?
R: Sì, l’idrossido di ferro esiste in forma solida.
D: Cosa produce l’idrossido di ferro decomposto termicamente?
R: Il Fe(OH)₃ decomposto termicamente produce ossido di ferro(III) (Fe₂O₃) e acqua.
D: L’idrossido di ferro è solubile in acqua?
R: No, l’idrossido di ferro non è solubile in acqua. Forma un precipitato se miscelato con acqua.
