L’etilbenzene (C8H10) è un composto organico con un odore dolce. Viene utilizzato come solvente in vari settori, tra cui plastica e gomma. Si trova anche nella benzina e viene utilizzato nella composizione di alcuni prodotti per la casa.
| Nome IUPAC | Etilbenzene |
| Formula molecolare | C8H10 |
| numero CAS | 100-41-4 |
| Sinonimi | Etilbenzolo, EB, feniletano, etilfenile, 2-feniletano, alfa-metiltoluene, 1-feniletano, etilbenzene, diluente stirene |
| InChI | InChI=1S/C8H10/c1-2-8-6-4-3-5-7-8/h3-7H,2H2,1H3 |
Proprietà dell’etilbenzene
Formula dell’etilbenzene
La formula molecolare dell’etilbenzene è C8H10, il che significa che è costituito da otto atomi di carbonio e dieci atomi di idrogeno. La struttura chimica dell’etilbenzene presenta un anello benzenico attaccato a un gruppo etilico.
Massa molare dell’etilbenzene
La massa molare di C8H10 è 106,17 g/mol. Questo viene calcolato sommando le masse atomiche di tutti gli atomi in una molecola C8H10.
Punto di ebollizione dell’etilbenzene
Il punto di ebollizione di C8H10 è 136,2°C (277,2°F). Questa è la temperatura alla quale la forma liquida di C8H10 si trasforma in gas. C8H10 ha un punto di ebollizione relativamente basso rispetto ad altri idrocarburi aromatici, rendendolo utile come solvente in vari settori.
Punto di fusione dell’etilbenzene
Il punto di fusione di C8H10 è -95,2°C (-139,4°F). Questa è la temperatura alla quale la forma solida di C8H10 si trasforma in un liquido. C8H10 ha un punto di fusione relativamente basso rispetto ad altri idrocarburi aromatici, rendendolo utile come materia prima per la produzione di altri prodotti chimici.
Densità dell’etilbenzene g/mL
La densità di C8H10 è 0,867 g/mL a 20°C (68°F). Ciò significa che un millilitro di C8H10 pesa 0,867 grammi a questa temperatura. C8H10 è meno denso dell’acqua, il che significa che galleggerà sulla superficie dell’acqua se i due liquidi vengono mescolati.
Peso molecolare dell’etilbenzene
Il peso molecolare di C8H10 è 106,17 g/mol. Questa è la massa di una molecola C8H10, che può essere calcolata sommando le masse atomiche di tutti gli atomi della molecola.
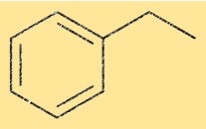
Struttura dell’etilbenzene
La struttura di C8H10 è costituita da un anello benzenico attaccato ad un gruppo etilico. Il gruppo etilico è attaccato ad uno degli atomi di carbonio dell’anello benzenico. Questa struttura è anche conosciuta come feniletano.
Solubilità dell’etilbenzene
C8H10 è insolubile in acqua ma solubile in solventi organici come alcoli, eteri e cloroformio. Ciò significa che C8H10 non si dissolve in acqua, ma si dissolve in altri liquidi con proprietà chimiche simili. La solubilità di C8H10 in vari solventi dipende da fattori quali temperatura, pressione e proprietà chimiche del solvente.
| Aspetto | Liquido incolore |
| Peso specifico | 0,867 g/ml a 20°C |
| Colore | Incolore |
| Odore | Aroma dolce |
| Massa molare | 106,17 g/mole |
| Densità | 0,867 g/ml a 20°C |
| Punto di fusione | -95,2°C (-139,4°F) |
| Punto di ebollizione | 136,2°C (277,2°F) |
| Punto flash | 11,1°C (52°F) |
| solubilità in acqua | 0,30 g/l a 20°C |
| Solubilità | Solubile in solventi organici come alcoli, eteri e cloroformio |
| Pressione del vapore | 10,7 mmHg a 20°C |
| Densità del vapore | 3.7 |
| pKa | 10.17 |
| pH | Non applicabile |
Sicurezza e pericoli dell’etilbenzene
C8H10 può essere pericoloso se non vengono prese le dovute precauzioni durante la manipolazione e l’utilizzo. È classificato come liquido infiammabile e può accendersi se esposto a calore o fiamme. C8H10 può anche essere nocivo se inalato o ingerito. L’esposizione ad alte concentrazioni di C8H10 può provocare vertigini, mal di testa e irritazione respiratoria. L’esposizione a lungo termine a C8H10 è stata associata a danni al fegato e ai reni. È necessario adottare precauzioni di sicurezza quando si lavora con C8H10, come indossare indumenti e guanti protettivi, lavorare in aree ben ventilate e conservarlo in un luogo sicuro, fresco e asciutto.
| Simboli di pericolo | Infiammabile, nocivo |
| Descrizione della sicurezza | Tenere lontano da fonti di calore, scintille, fiamme libere e superfici calde. Utilizzare attrezzature a prova di esplosione. Evitare di respirare polvere/fumi/gas/nebbia/vapori/aerosol. Lavare bene dopo aver maneggiato. |
| Numeri di identificazione delle Nazioni Unite | ONU 1175 |
| Codice SA | 2902.90.20 |
| Classe di pericolo | 3 (Liquidi infiammabili) |
| Gruppo di imballaggio | II (Pericolo medio) |
| Tossicità | L’etilbenzene è considerata una sostanza moderatamente tossica. Può causare irritazione agli occhi e alla pelle, problemi respiratori e danni al sistema nervoso se l’esposizione è prolungata o ad alte concentrazioni. |
Metodi per la sintesi dell’etilbenzene
Il metodo più comunemente utilizzato per sintetizzare C8H10 è la deidrogenazione catalitica dell’etilcicloesano. Questo processo prevede il riscaldamento di una miscela di etilcicloesano e idrogeno gassoso su un catalizzatore ad alta temperatura, che provoca la separazione degli atomi di idrogeno dal gruppo etilico, con conseguente formazione di C8H10.
Un altro metodo per sintetizzare C8H10 prevede l’alchilazione del benzene con gas etilene . Questa reazione richiede un catalizzatore, solitamente cloruro di alluminio, e provoca la formazione di C8H10 e acido cloridrico come sottoprodotto.
Un metodo alternativo per produrre C8H10 prevede la reazione del benzene con cloruro di etile in presenza di un catalizzatore acido di Lewis, come il cloruro di alluminio. Questo processo porta alla formazione di C8H10 e acido cloridrico come sottoprodotto.
Oltre ai metodi citati, i ricercatori stanno anche sviluppando nuovi metodi per sintetizzare C8H10, come l’utilizzo di liquidi ionici come solvente per l’alchilazione dell’etilene del benzene . Questi metodi hanno il potenziale per offrire vantaggi in termini di efficienza e sostenibilità ambientale. Tuttavia, il loro uso industriale non è ancora diffuso.
Usi dell’etilbenzene
C8H10 ha diversi usi importanti in vari settori. Alcuni dei suoi usi principali sono:
- Produzione di stirene: la produzione di stirene, utilizzato per produrre una varietà di plastiche, resine e gomma sintetica, legato a C8H10 come intermedio chiave.
- Solvente: comunemente utilizzato come solvente per varie applicazioni, inclusi inchiostri, rivestimenti, adesivi e prodotti per la pulizia.
- Additivo per carburante: aggiunto alla benzina per migliorarne il numero di ottano, che può migliorare le prestazioni del motore.
- Intermedio chimico: utilizzato come materia prima per la sintesi di altri prodotti chimici, come feniletanolo e dietilbenzene.
- Produzione di polimeri: utilizzata nella produzione di vari tipi di polimeri, come le resine di polistirene e acrilonitrile-butadiene-stirene (ABS).
- Agricoltura: utilizzato anche come pesticida ed erbicida.
- Applicazioni mediche: utilizzato come anestetico locale e come solvente per prodotti farmaceutici.
Domande:
D: Quanti segnali ti aspetteresti di vedere nello spettro 1H NMR dell’etilbenzene?
R: Lo spettro 1H NMR per C8H10 avrebbe quattro segnali: due per i protoni sull’anello benzenico (che apparirebbe come un doppietto) e due per i protoni sul gruppo etilico (che apparirebbe come una tripletta).
D: Quali proporzioni di benzene ed etilbenzene devono essere miscelate?
R: Le proporzioni di benzene e C8H10 da miscelare dipendono dalla concentrazione desiderata di C8H10 nella miscela. Il rapporto benzene/C8H10 può variare da 10:1 a 1:1, a seconda dell’applicazione.
D: Cos’è la nitrazione dell’etilbenzene?
R: La nitrazione di C8H10 comporta la reazione di C8H10 con una miscela di acido nitrico e acido solforico, con conseguente introduzione di uno o più gruppi nitro sull’anello benzenico di C8H10. Questa reazione è comunemente utilizzata nella produzione di prodotti chimici industriali come nitrobenzene e feniletilammine.
D: L’etilbenzene è polare?
R: C8H10 è un composto non polare a causa della struttura simmetrica dell’anello benzenico, che nega qualsiasi polarità del gruppo etilico. Di conseguenza, C8H10 ha una bassa solubilità in acqua ed è generalmente solubile in solventi non polari come esano e toluene.
D: Come passare dall’etilbenzene allo stirene?
R: C8H10 può essere convertito in stirene attraverso il processo di deidrogenazione, che prevede la rimozione di due atomi di idrogeno dal gruppo etilico utilizzando un catalizzatore come ossido di ferro o ossido di cromo. Questo processo porta alla formazione di stirene e idrogeno come sottoprodotto. Lo stirene risultante può poi essere purificato e utilizzato nella produzione di vari materiali industriali come plastica, resine e gomma sintetica.
