L’etano è un idrocarburo con la formula chimica C2H6. È comunemente usato come combustibile ed è un componente del gas naturale. L’etano ha due atomi di carbonio e sei atomi di idrogeno.
| Nome IUPAC | Etano |
| Formula molecolare | C2H6 |
| numero CAS | 74-84-0 |
| Sinonimi | Dietile, dimetil, etile idruro, metilmetano |
| InChI | InChI=1S/C2H6/c1-2/h1-2H3 |
Proprietà dell’etano
Formula dell’etano
La formula chimica dell’etano è C2H6. Ciò indica che ciascuna molecola di etano è composta da due atomi di carbonio e sei atomi di idrogeno. La formula ci aiuta a comprendere la composizione dell’etano e la sua disposizione strutturale.
Massa molare dell’etano
La massa molare dell’idruro di etile si calcola sommando le masse atomiche dei suoi elementi costitutivi. Il carbonio ha una massa atomica di 12,01 g/mol e l’idrogeno ha una massa atomica di 1,008 g/mol. Moltiplicando le masse atomiche per i rispettivi conteggi e sommandole si ottiene la massa molare dell’idruro di etile, che è di circa 30,07 g/mol.
Punto di ebollizione dell’etano
L’idruro di etile ha un punto di ebollizione di -88,6 gradi Celsius. Ciò significa che alla pressione atmosferica standard, l’idruro di etile cambierà da liquido a gas quando riscaldato a quella temperatura. Il punto di ebollizione è una proprietà importante perché determina le condizioni in cui l’idruro di etile può essere vaporizzato.
Punto di fusione dell’etano
Il punto di fusione dell’idruro di etile è -182,8 gradi Celsius. A temperature inferiori a questo punto, l’idruro di etile esiste in forma solida. Quando riscaldato a questa temperatura o superiore, l’idruro di etile subisce un cambiamento di fase dallo stato solido a quello liquido. Il punto di fusione è fondamentale per comprendere il comportamento fisico dell’idruro di etile durante i processi di raffreddamento o riscaldamento.
Densità dell’etano g/mL
La densità dell’idruro di etile è di circa 0,55 g/mL a temperatura e pressione standard. La densità è una misura della quantità di massa presente in un dato volume. Nel caso dell’idruro di etile, ci dice quanto sono fitte le sue molecole e fornisce informazioni sulle sue proprietà fisiche.
Peso molecolare dell’etano
Il peso molecolare dell’idruro di etile è 30,07 g/mol. È la somma delle masse atomiche di tutti gli atomi in una singola molecola di idruro di etile. Il peso molecolare ci aiuta a determinare la quantità di idruro di etile presente in una determinata massa o volume.
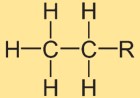
Struttura dell’etano
La struttura dell’idruro di etile è costituita da due atomi di carbonio legati insieme da un singolo legame covalente. Ogni atomo di carbonio è circondato da tre atomi di idrogeno. La disposizione strutturale è lineare, con gli atomi di idrogeno posizionati simmetricamente attorno al legame carbonio-carbonio.
Solubilità dell’etano
L’idruro di etile non è molto solubile in acqua. È una molecola non polare, mentre l’acqua è un solvente polare. Le molecole non polari come l’idruro di etile hanno forze intermolecolari deboli e non si dissolvono facilmente nei solventi polari. Tuttavia, l’idruro di etile può dissolversi in altri solventi non polari, come l’esano o il benzene.
| Aspetto | Gas incolore |
| Peso specifico | 1.038 g/litro |
| Colore | N / A |
| Odore | Inodore |
| Massa molare | 30,07 g/mole |
| Densità | 0,55 g/ml |
| Punto di fusione | -182,8°C |
| Punto di ebollizione | -88,6°C |
| Punto flash | -135°C |
| solubilità in acqua | Insolubile |
| Solubilità | Solubile in solventi non polari |
| Pressione del vapore | 46,9 PSI (a 21°C) |
| Densità del vapore | 1,52 (aria = 1) |
| pKa | ~50 |
| pH | N / A |
Sicurezza e pericoli dell’etano
L’idruro di etile presenta diverse considerazioni e pericoli sulla sicurezza. È altamente infiammabile e può formare miscele esplosive con l’aria. Se esposto a una fiamma o a una fonte di calore, l’idruro di etile può accendersi, provocando incendi o esplosioni. È importante maneggiare e conservare l’idruro di etile in aree ben ventilate, lontano da fonti di ignizione. L’idruro di etile rappresenta anche un pericolo di asfissia perché sposta l’ossigeno negli spazi chiusi. L’inalazione di alte concentrazioni di idruro di etile può causare vertigini, nausea e persino perdita di coscienza. È essenziale utilizzare dispositivi di protezione individuale adeguati e seguire i protocolli di sicurezza quando si lavora con o in prossimità dell’idruro di etile per mitigare questi rischi.
| Simboli di pericolo | Gas infiammabile |
| Descrizione della sicurezza | Tenere lontano da fonti di calore, scintille e fiamme libere. Utilizzare in aree ben ventilate. Maneggiare con le opportune precauzioni per evitare il rischio di incendio o esplosione. |
| Numeri di identificazione delle Nazioni Unite | UN1035 |
| Codice SA | 29011000 |
| Classe di pericolo | 2.1 (Gas infiammabile) |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | L’etano non è considerato altamente tossico. Tuttavia, l’inalazione di elevate concentrazioni può causare asfissia. Utilizzare con ventilazione adeguata ed evitare l’esposizione prolungata. |
Metodi di sintesi dell’etano
Vari metodi sintetizzano l’idruro di etile.
Un metodo comune è il processo di steam cracking, in cui alte temperature (da circa 750 a 900 °C) riscaldano idrocarburi, solitamente idruro di etile o idrocarburi più pesanti, in presenza di vapore. Questo processo innesca reazioni tra cui la decomposizione termica e il riarrangiamento, producendo idruro di etile, etilene e propilene.
Un altro metodo prevede l’idrogenazione catalitica dell’acetilene , dove il gas acetilene reagisce con l’idrogeno su catalizzatori adatti come palladio o nichel, producendo idruro di etile. Questo metodo converte selettivamente l’acetilene altamente reattivo e potenzialmente pericoloso in un idruro di etile più stabile e meno reattivo.
L’etano può anche essere ottenuto dal gas naturale mediante estrazione criogenica. Il gas naturale, principalmente l’idruro di metile, è sottoposto a basse temperature e pressioni elevate per separare e recuperare l’idruro di etile. Gli impianti di lavorazione del gas naturale utilizzano comunemente questo processo per estrarre prezioso idruro di etile per varie applicazioni industriali.
Inoltre, la raffinazione del petrolio e alcuni processi petrolchimici generano idruro di etile come sottoprodotto. Tecniche come la distillazione o l’assorbimento separano l’idruro di etile da altri flussi di idrocarburi.
Nel complesso, questi metodi di sintesi consentono la produzione di idruro di etile, una materia prima fondamentale per la produzione di un’ampia gamma di prodotti chimici, plastiche e combustibili, che contribuisce a molte industrie in tutto il mondo.
Usi dell’etano
L’idruro di etile trova applicazione in vari settori grazie alle sue proprietà versatili. Ecco alcuni usi chiave dell’idruro di etile:
- Industria petrolchimica: l’idruro di etile è una materia prima essenziale per la produzione di etilene, che funge da base per plastica, resine e fibre sintetiche. È un elemento chiave nella produzione del polietilene, una delle materie plastiche più utilizzate al mondo.
- Carburante ed energia: l’idruro di etile svolge un ruolo nell’alimentazione e nell’alimentazione di specifici processi industriali ed è un costituente del gas naturale. Le industrie bruciano l’idruro di etile per produrre calore o elettricità, fungendo da fonte di energia per applicazioni residenziali, commerciali e industriali.
- Refrigerazione: in alcune applicazioni, come i sistemi a bassa temperatura, l’idruro di etile funge da refrigerante, fornendo capacità di raffreddamento efficienti. Offre efficienti capacità di raffreddamento ed è un’alternativa ad altri refrigeranti con un maggiore impatto ambientale.
- Solvente: L’idruro di etile funge da solvente non polare, soprattutto in laboratorio. L’idruro di etile facilita processi come l’estrazione, la purificazione e l’analisi.
- Gas di calibrazione: l’idruro di etile funge da componente nella calibrazione di miscele di gas per rilevatori e analizzatori di gas, consentendo la calibrazione e la verifica delle apparecchiature di rilevamento del gas.
- Propellente aerosol: l’idruro di etile funziona come propellente aerosol in vari prodotti, espellendone il contenuto dal contenitore al rilascio della pressione. Impartisce la forza necessaria per spruzzare sostanze come cosmetici, vernici e prodotti per la casa.
- Sintesi chimica: l’idruro di etile funge da materia prima per la sintesi di una varietà di prodotti chimici organici, tra cui etanolo, ossido di etilene e cloruro di vinile. Queste sostanze chimiche trovano applicazione, tra gli altri, nella produzione di solventi, plastica, detergenti e tubi in PVC.
Queste diverse applicazioni evidenziano l’importanza dell’idruro di etile in diversi settori, rendendolo un elemento cruciale nella produzione moderna e nella vita di tutti i giorni.
Domande:
D: C2H6 è polare o non polare?
R: C2H6 (idruro di etile) è una molecola non polare perché la differenza di elettronegatività tra carbonio e idrogeno è piccola, risultando in una distribuzione uniforme della densità elettronica.
D: Quante moli di atomi di carbonio ci sono in 0,500 moli di C2H6?
R: In 0,500 moli di C2H6 ci sono 1,00 moli di atomi di carbonio poiché ciascuna molecola di C2H6 contiene 2 atomi di carbonio.
D: Qual è la formula empirica per C2H6?
R: La formula empirica per C2H6 è CH3, che rappresenta il rapporto più semplice tra gli atomi presenti nella molecola.
D: Cos’è C2H6?
R: C2H6 è la formula chimica dell’idruro di etile, un idrocarburo gassoso comunemente utilizzato come combustibile e componente del gas naturale.
D: Perché l’etano (C2H6) non ha isomeri strutturali?
R: L’idruro di etile (C2H6) non ha isomeri strutturali perché i suoi atomi di carbonio sono uniti da un singolo legame, risultando in una struttura lineare senza altra disposizione possibile.
D: C2H6 ha un legame idrogeno?
R: C2H6 (idruro di etile) non ha un legame idrogeno perché manca di atomi di idrogeno legati a elementi altamente elettronegativi come azoto, ossigeno o fluoro.
D: C2H6 è ionico o covalente?
R: C2H6 è un composto covalente perché è formato dalla condivisione di elettroni tra atomi di carbonio e idrogeno.
D: C2H6 è solubile in acqua?
R: C2H6 è insolubile in acqua perché è una molecola non polare e non si dissolve facilmente nel solvente polare.
D: Una miscela di gas contiene CH4 e C2H6 in proporzione equimolare?
R: Sì, se la miscela di gas contiene CH4 e C2H6 in proporzione equimolare, significa che il numero di moli di CH4 è uguale al numero di moli di C2H6 nella miscela.
